関連記事
オンコリスバイオファーマ、創薬メーカーからウイルス創薬及びウイルス製薬メーカーへ領域拡大を目指す

オンコリスバイオファーマ、創薬メーカーからウイルス創薬及びウイルス製薬メーカーへ領域拡大を目指す[写真拡大]
2022年中間業績の概要
浦田泰生氏(以下、浦田):本日は2022年度の中間業績の発表に続いて、各パイプラインの進捗状況、今後の方針やマイルストーンといった順でお話しさせていただきます。よろしくお願いします。
はじめに中間業績についてです。こちらは吉村取締役からご説明したいと思います。
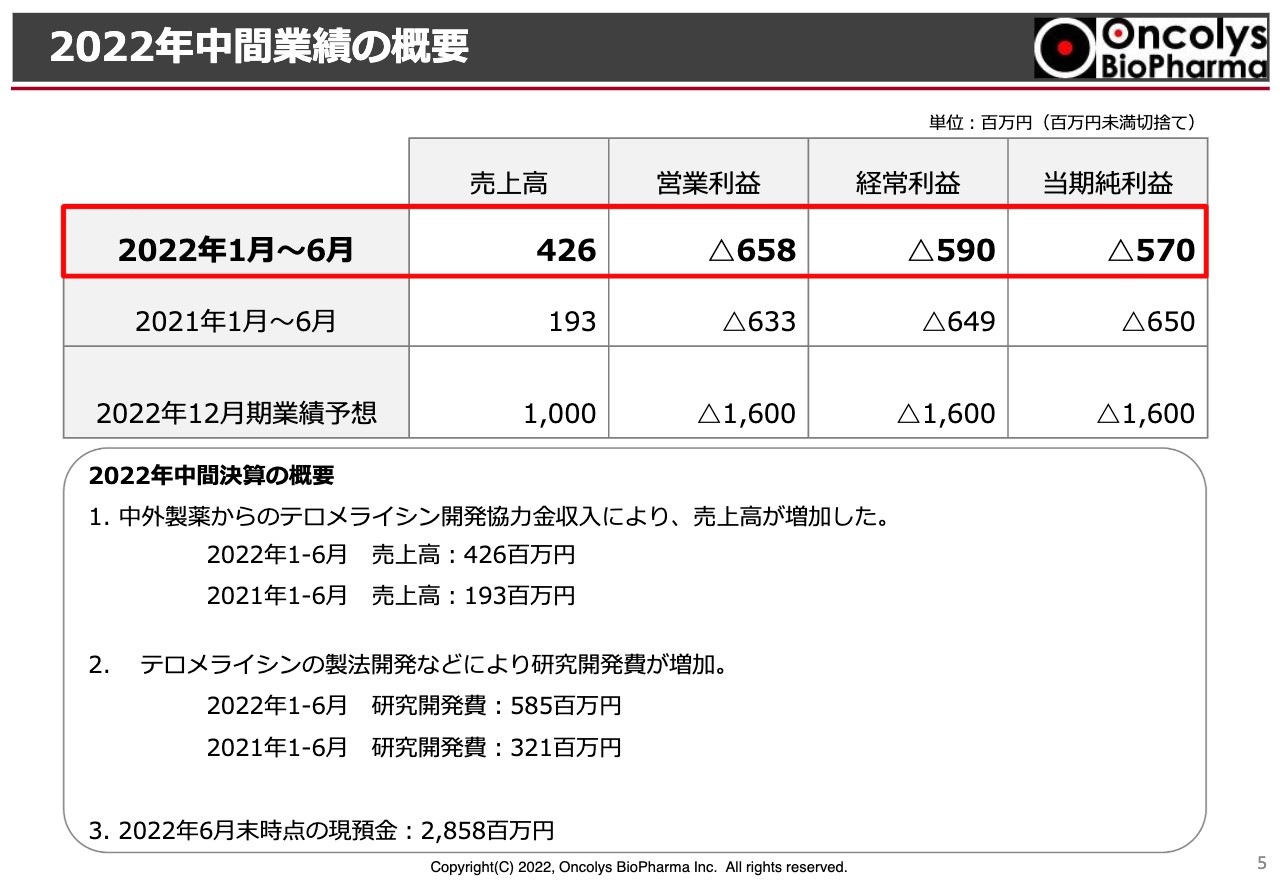
吉村圭司氏(以下、吉村):当社の上半期の業績を発表します。売上高は4億2,600万円、営業利益はマイナス6億5,800万円、経常利益はマイナス5億9,000万円、当期純利益はマイナス5億7,000万円となりました。期初に掲げた今期業績予想の売上高10億円、営業利益と当期純利益がマイナス16億円からは変更ありません。
特に売上高に関しては、今期に入って中外製薬からの「テロメライシン」の開発協力金が大幅に増えたことにより増加しています。また、研究開発費についても「テロメライシン」の製法開発などによって、中間で5億8,500万円となっており、前年同期比で2億6,000万円増となっています。預金残高については、6月末時点において28億5,800万円です。
2022年上半期のトピックス①

浦田:2022年上半期のトピックスをご紹介します。「テロメライシン」については、昨年10月に中外製薬とのライセンス契約解消の通告がありました。実際の解消は今年の10月15日になるのですが、中外製薬からの臨床データなどの引き継ぎについては、非常に順調に進行しています。
そして間もなく、治験届を中外製薬からオンコリスバイオファーマに変更する申請が承認されることになると思います。そのため、「2024年に国内で承認申請を行う」という中外製薬が決定した状況から変更はありません。
また、食道がんの臨床試験も行っていますが、放射線併用における「Phase2」の症例の組入れはほとんど終わっており、本日も内視鏡の検討会等を行っています。この試験は中外製薬の全額費用負担によって組入れが行われてきました。
GMP製造については、ベルギーのヘノジェン社と組んで製造を行っています。先月も当社社員がヘノジェン社を訪問し、テスト製造に立ち会いました。第1回目のテスト製造がうまくいっていますので、近々にGMP製造へ移れるのではないかと期待しています。
国内においては、当社独自で承認申請を行いたいと思っています。そのため、特に販売におけるパートナーや、将来的に効能追加を行っていく上でのライセンスも含めたパートナーの探索を行っています。
一方、アメリカで実施していた頭頸部がんの試験についてです。頭頸部がんの治療自体が、チェックポイント阻害剤との併用が主体になってきたことから、当社が考えていたケモラジとの併用は今後うまくいかないのではないかということになりました。そのため、いったん組入れを終了し、試験計画を立て直します。その後、製薬メーカーと組めるかどうかチャレンジしていきたいと考えています。
同様にアメリカで試験を行っている胃がん・食道がんについては、後ほどご説明しますが、予定症例18例中15例まで進んだところで、何例かのレスポンダーが出ています。このままレスポンダーが続くようであれば、チェックポイント阻害剤によって胃がん・食道がんで治療法は変わってきますが、それを見越した治験計画を出して、メガファーマとのライセンスあるいは共同研究の交渉を開始します。以上が「テロメライシン」の状況になります。
2022年上半期のトピックス②

その他のパイプラインについてもご報告します。経口コロナ治療薬「OBP-2011」は、昨今のAMEDの募集においては残念ながら落選しました。しかし、今後もメカニズムの解明を続けていきます。
明らかなメカニズムが解明された場合は、製薬メーカーとの新たな化合物の探索も可能です。あるいは、「OBP-2011」でもメカニズムが十分であるということがわかれば、経口剤のほうが理想的ですが、例えば、鼻から吸入するような製剤に切り替えて、製薬メーカーとの共同開発やライセンスにつなげられないか模索していきたいと考えています。
「OBP-601」は、もともと当社が抗HIV薬として開発していた化合物です。こちらもTransposon社での臨床開発が順調に進捗しており、いわゆる神経難病であるPSP(進行性核上性麻痺)やALSという筋肉が損傷していく病気、あるいはFTDという前頭葉型認知症の治験の組入れも順調に進んでいます。これらはTransposon社の全額負担で臨床試験を進めています。
第2世代の「テロメライシン」である「OBP-702」は、岡山大学のAMED研究費を利用して、前臨床試験とGMPに向けた製造が進められています。
「テロメスキャン」については、順天堂大学との共同研究開発講座が進められています。それ以外にも、AIを用いた自動検出ソフトウェアを開発するために、日本国内のベンチャー企業であるCYBO社との共同開発契約を締結しています。
一方で、コーポレートにおいては、資本金および資本準備金の減資を行いました。そのため、現在の資本金は30億円となっています。
資金充当計画の変更
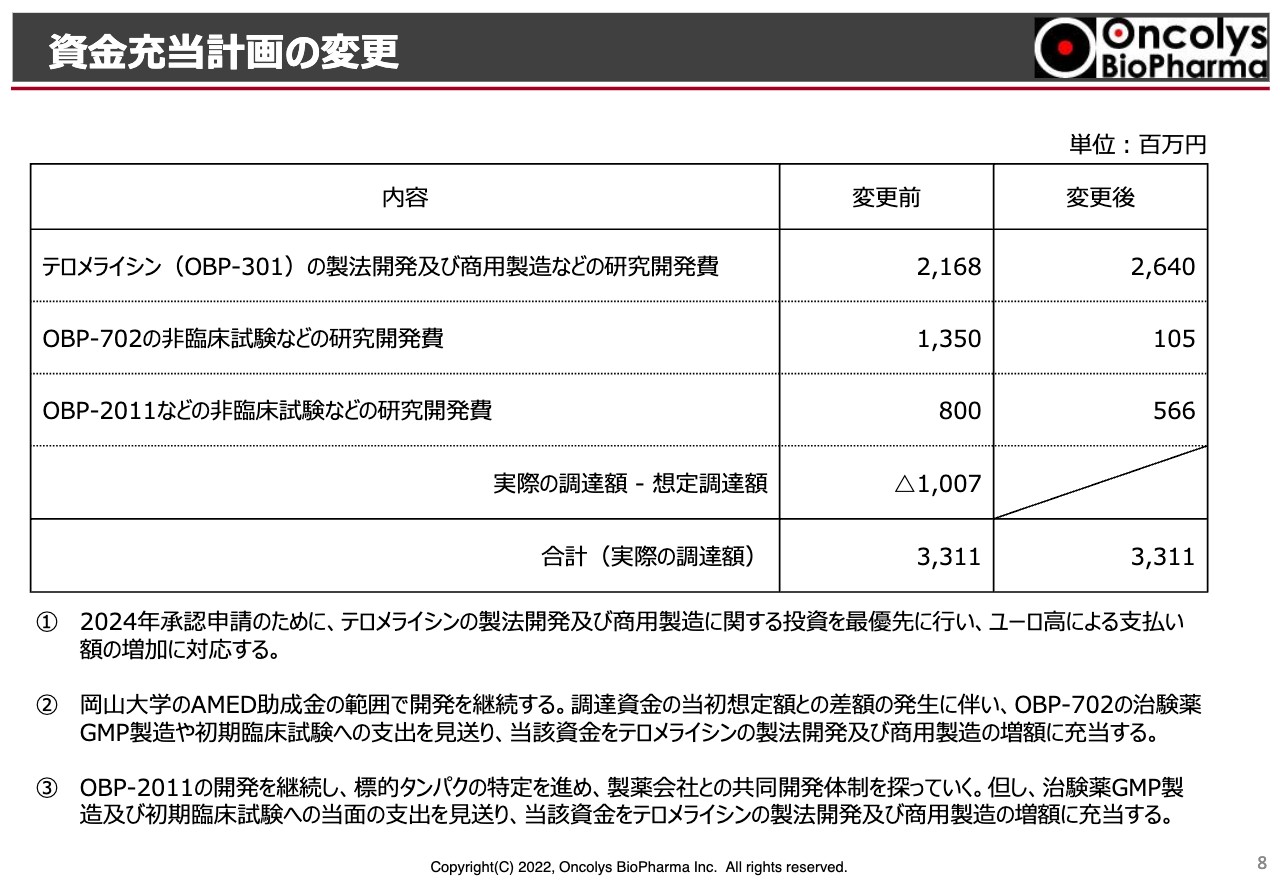
吉村:資金充当計画の変更についてご報告します。2020年12月当初は40億円以上の資金調達を目標にしていましたが、実際の調達額は33億円に留まっています。その中で、今後の「OBP-301」「OBP-702」「OBP-2011」の資金の使途について、変更します。
先ほどの話にもあったとおり、2024年の「テロメライシン」の申請に向けて、製法開発・商用製造のための研究費として、当初は21億6,800万円を予定していました。しかし、この投資を最優先にすることに加え、現在のユーロ高による支払いの増加を見込んで、26億4,000万円としたいと考えています。
反対に「OBP-702」については、岡山大学のAMEDの助成金の範囲内で開発を継続することにしたいと思っています。そのため、非臨床試験などの研究開発費に特化し、「OBP-702」の治験薬のGMP製造や初期臨床試験用の支出は見送りたいと考えています。
同様に「OBP-2011」についても当初8億円の支出を予定していましたが、治験薬のGMP製造および初期臨床試験への支出は当面見送り、見送る資金を「テロメライシン」の製法開発などに集中させたいと考えています。ただし、開発は継続するものとし、標的タンパクの特定を進めて、製薬会社との共同開発体制を探っていきます。
パイプライン開発一覧
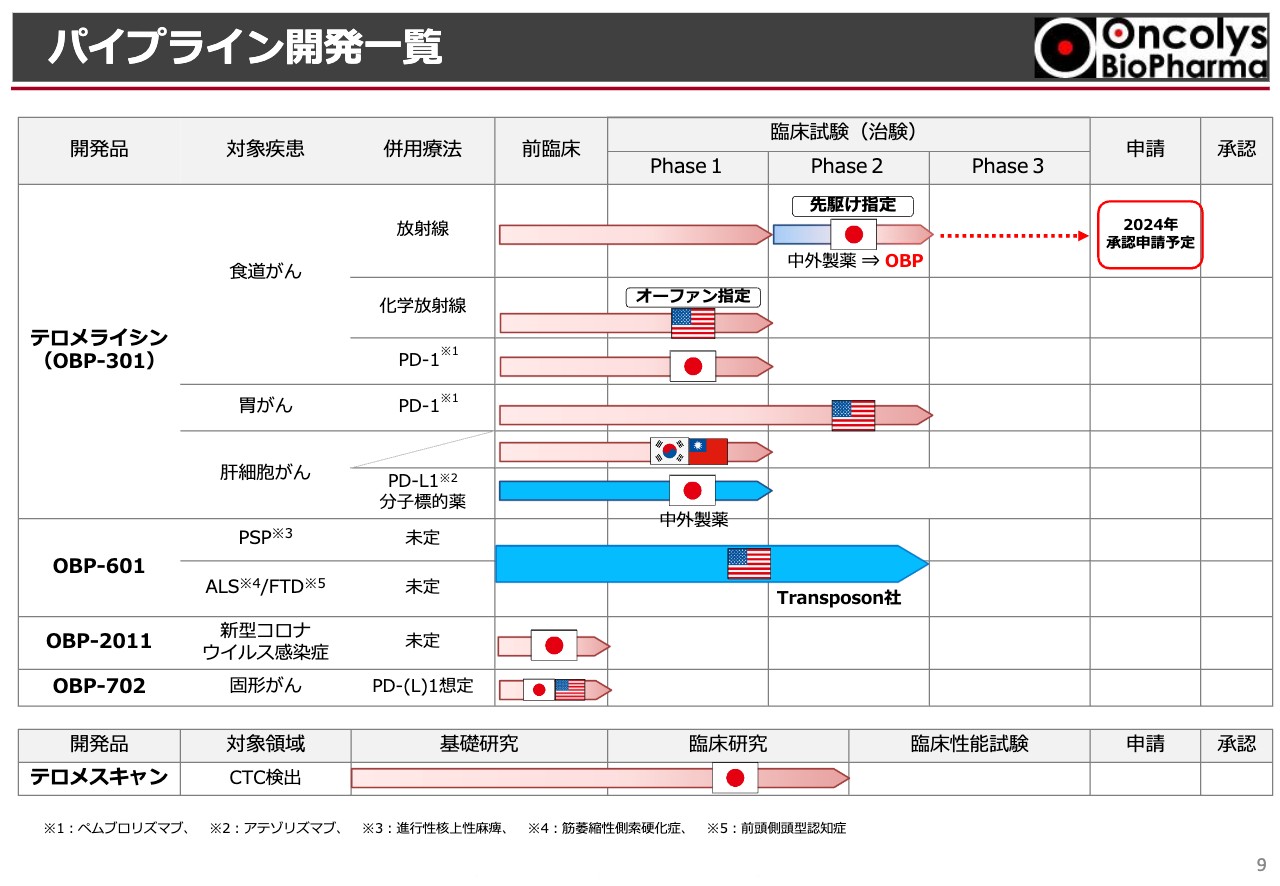
浦田:現段階でのパイプライン開発一覧をスライドに記載しています。表の上半分が「テロメライシン」で、食道がん・胃がん・肝細胞がんの臨床試験の進捗状況を示しています。
トップラインである放射線併用の食道がんは、通常ですと「Phase3」までありますが、臨床試験の先駆け承認の指定を受けているため、「Phase2」で承認申請の目前まで来ています。他に「Phase2」に進んでいるのはアメリカでの胃がんの試験と、「OBP-601」のTransposon社での臨床試験です。
中外製薬との主な合意事項

ここからは個別にお話ししていきます。食道がんの臨床試験については、昨年10月より、中外製薬から臨床試験の引き継ぎを行っています。当社が引き継ぎを完了するまでは、中外製薬の費用負担で臨床試験を実施し、またGMP製造については10月15日までの請求分において、請求額の約50パーセントを中外製薬が負担するという条件も守られています。
一方で、中外製薬が主体となって開始していた肝細胞がんの臨床試験には中外製薬の化合物が使われていました。そのため、当社との契約解除によって、今後はそのようなコンビネーションが考えにくいことから、中外製薬との協議により終了することとしました。ただし、少数ではありますが、これまでも臨床試験が進んでいましたので、中外製薬から当社に結果報告書が送られてくる予定になっています。
中外製薬から引き継ぐ放射線併用食道がんPhase2
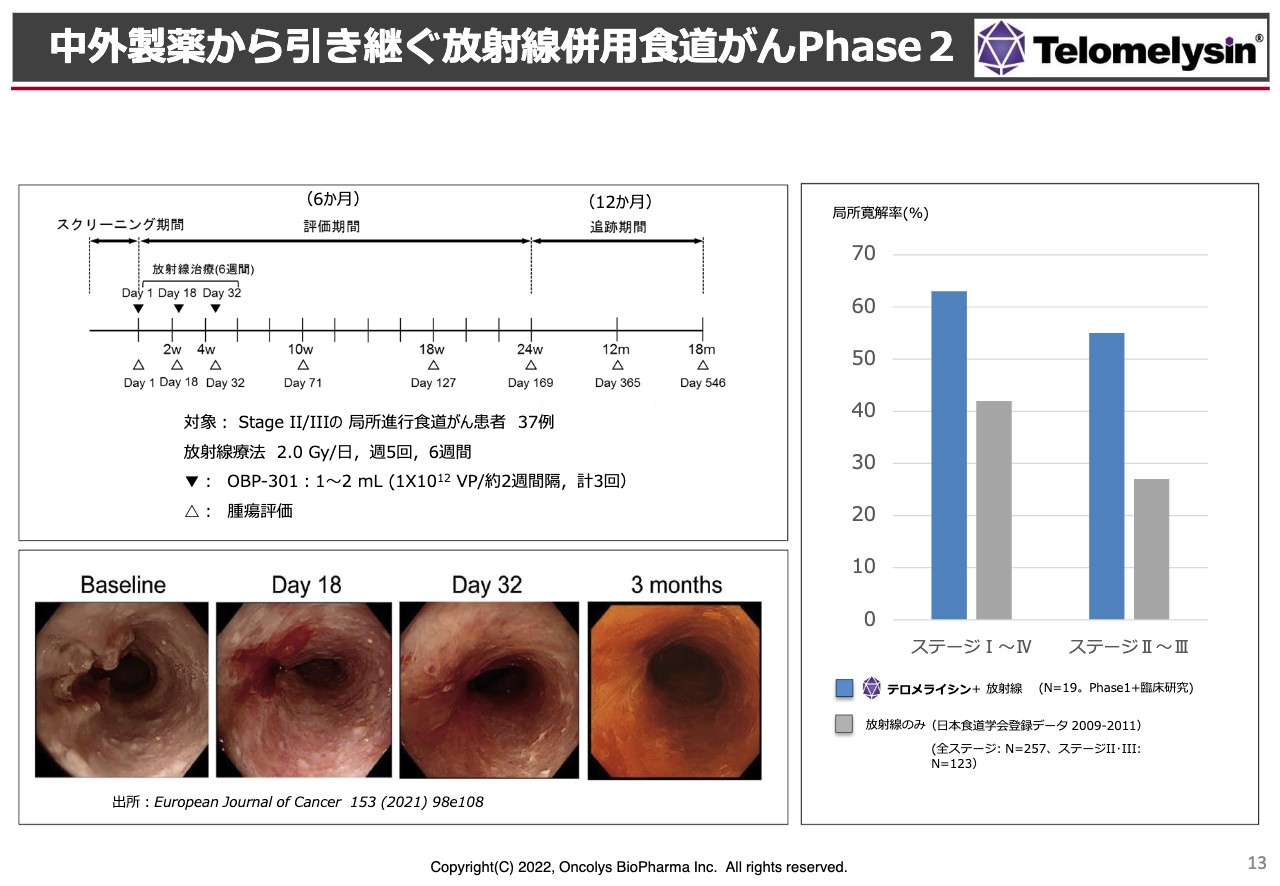
現在進行中の放射線治療だけを併用した「Phase2」の臨床試験についてです。これまでに何度もお話ししてきましたが、スライド右側の棒グラフにあるとおり、臨床試験のプロトコルはステージⅡ・ステージⅢの局所進行型の食道がんを対象にしています。ここに「テロメライシン」を2週間おきに3回投与するというのが臨床試験の計画で進んでいます。
放射線単独では約30パーセントの局所の治癒率が学会データとして出ています。しかし、「テロメライシン」を併用することで60パーセント近い局所の治癒率が得られます。このような実績が評価されたことが、治験の先駆け指定を受けることができた要因です。
現在、「Phase2」の臨床試験は組み入れがあと少しという段階まで来ています。そのため、年内の組入れについては先が見えてきた状況です。
国内放射線併用食道がんPhase2以外の治験

国内においては放射線併用以外の臨床試験も行っています。1つ目の国内肝細胞がんの「Phase1」の試験については先ほどお伝えしたとおりです。2つ目の食道がんの「Phase1」は、国内で実施した「ペムブロリズマブ」併用の臨床試験です。22例の組入れを完了して、論文化や学会報告を急いでもらっているのですが、医師主導試験だったため、こちらからはあまり口出しできません。
ただし、「彼ら独自のバイオマーカーが見えてきた」という中間報告を受けているため、このようなバイオマーカーの絞り込み、基礎実験、臨床試験をすべて含めた上で論文化や学会発表したいという意向です。来年4月に行われるアメリカのがん治療学会で発表するとのことですので、現在データをまとめているところだと思います。
3つ目は、アメリカで実施されている「ペムブロリズマブ」併用の胃がん・胃食道接合部がんの「Phase2」の臨床試験です。こちらは先ほど少しお話ししましたが、年内に18例を目標にしており、現在15例目です。この15例目がレスポンダーになるのではないかという報告を受けていますので、全体の結果は聞けていませんが、よい結果になりそうだということで、できるだけ早い学会報告をお願いしたいと思っています。
15例目が本当にレスポンダーになった場合には、18例目まで実施せずに試験を終えて、新たな抗PD-1抗体を併用するような試験計画を立て、メガファーマと協議しようという話になっています。すでにアポイントは取れていますので、協議が開始される状況になっていると理解しています。
4つ目は、ケモラジ併用の食道がんの「Phase1」です。こちらは「テロメライシン」が初めてケモセラピー、いわゆる化学療法との併用がなされる臨床試験ですので、安全性を見る上で非常に重要な試験です。こちらも12例を目標にして臨床試験が進められています。施設もどんどん増やしてもらっていますので、なんとか12例まで実施できるようにとアメリカで先生方とお話ししてきました。
米国頭頸部がんの「Phase2」については、2022年上半期のトッピクス①でお伝えしたとおりです。
テロメライシンの承認申請

食道がんに関する「テロメライシン」の承認申請についてです。国内で承認申請を取るためには、「手術不適応な局所進行性の食道がん」という効能・効果が求められると推察されます。そして、ここに「放射線療法を併用すること」という但し書きがつくと考えています。
このような症例がいったいどのくらいあるのかについては後ほどお伝えします。ただし、このような許可を取ることは、食道がんの局所治療薬としては初めての新薬承認となる可能性があります。
さらに、今後のデータ次第ですが、食道がんによって喉が詰まってしまう患者さまに対して、嚥下障害を取り除ける初めての薬になる可能性があります。嚥下障害、つまり食道が詰まってしまった場合には、通常は金属製のステントを入れます。しかし、これは患者さまにとっては飲み込む時に非常に苦痛ですので、「テロメライシン」は医療現場にとっても大きなメリットがあると考えています。
なおかつ、現段階では既存薬の抗がん剤のような重い副作用は報告されていません。そのため、手術不適応になるような心臓・肝臓・腎臓などの臓器が弱い方や、高齢の方にとってファーストライン治療になることが現実になっていくと思います。
ただし、本剤はマイナス60度以下の保存が必要ですので、デリバリーの際にはいろいろな条件が発生するという問題もあります。昨今は再生医療などが進んでいるため、デリバリーの会社にとって、マイナス60度以下の保存はそれほど大きな問題ではないと聞いてはいますが、片付けるべき問題点として挙がっています。
国内放射線併用食道がんPhase2の特徴
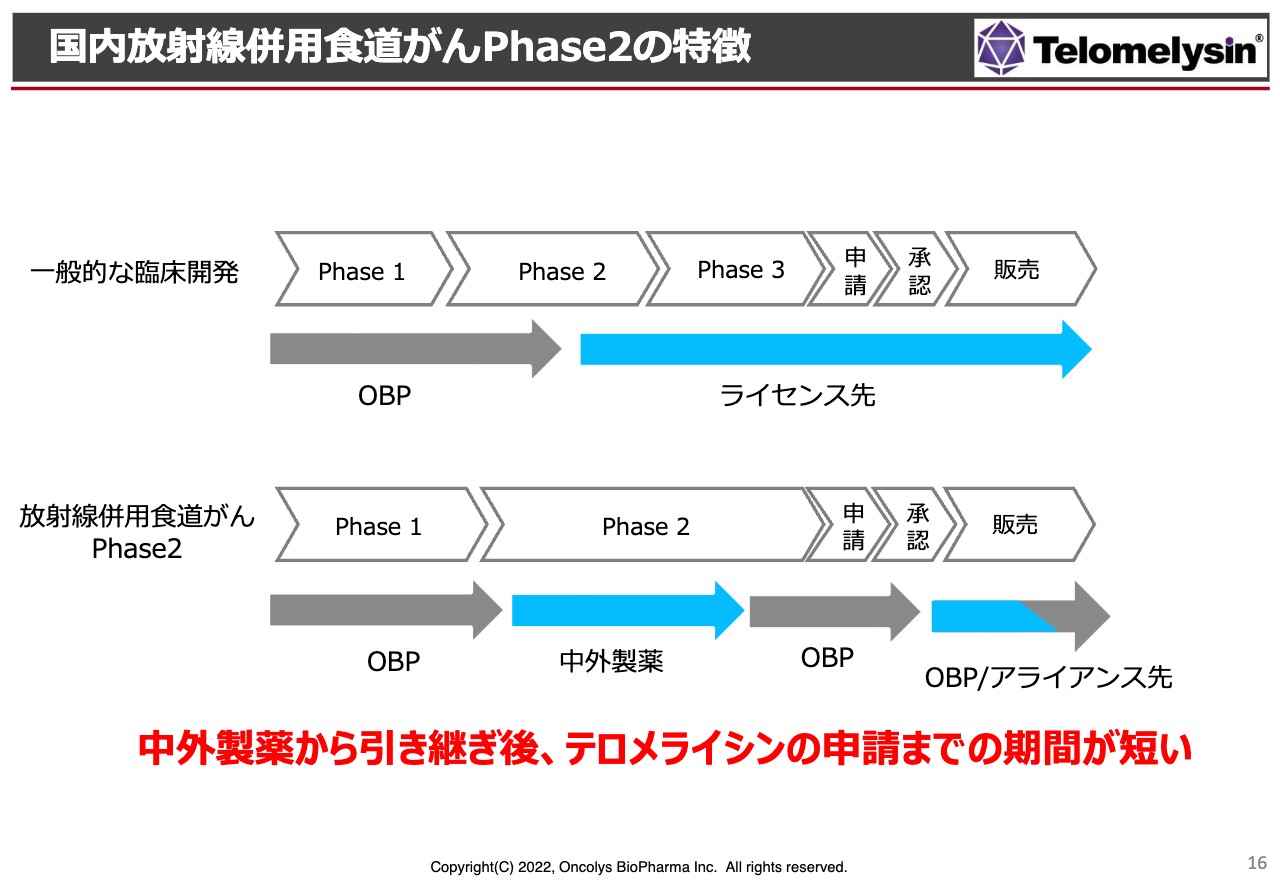
食道がんの「Phase2」については、先ほどお伝えしたとおり、厚生労働省から先駆け承認の指定を受けています。また、症例数が非常に少ないため、近い将来オーファン指定を取りにいく予定です。
通常、「Phase2」が終わった後のライセンスや残りの「Phase2」「Phase3」は大手製薬メーカーが行います。しかし、当社では「Phase2」のほとんどを中外製薬に実施してもらっており、最終的な申請・承認の段階を当社が行います。
この状況を考えると、当然、当社はライセンスを狙っていろいろな会社とお話ししているわけですが、やはり製薬メーカーはとにかく「Phase2」の最終結果を見たいということです。あるいは、仮に今からライセンス契約を結んでも、中外製薬がデータを出し始めるまでにだいたい1年近くの時間がかかったことを鑑みると、もう1度、今度はオンコリスから製薬企業にデータベースの移管を行うという非常に大きな無駄が生ずるということで、現段階では当社が承認申請まで持っていき、その後、販売あるいは効能追加に対するアライアンスを実現させていきたいと考えています。
“POST中外”に向けた状況

「POST中外」という言葉がスライドにありますが、当社単独で2024年中の承認申請を目指すという計画を変更することなく、なおかつベルギーでのGMP、商用製造のようなものは当社が指示を行って、品質試験あるいは製造方法のバリデーション等を行っていきます。一方で、これまでのものに関しては、中外製薬に50パーセントほど負担していただいている状況です。
スライドの今後のところは赤枠で囲んでいます。先ほどお話ししたように、ライセンスではなくて我々が独自で実施することと、もう1つ、当社独自で製造販売体制を構築するために、再生医療等製品の製造販売業の許可取得を目指していきます。このためには適切な人材の採用が必須となっています。
スライドの6番目に記載の医薬品卸売業・医療機器販売業の許可については、すでに取得しました。現在進行している臨床試験に対して、一部の医薬品あるいは医療機器を提供するためにはこのような業務の許可取得が必要なためです。今後は販売パートナーを見つけて、「テロメライシン」のマーケットをしっかり築いていくというのが当社の仕事になっていきます。
製薬+ライセンス
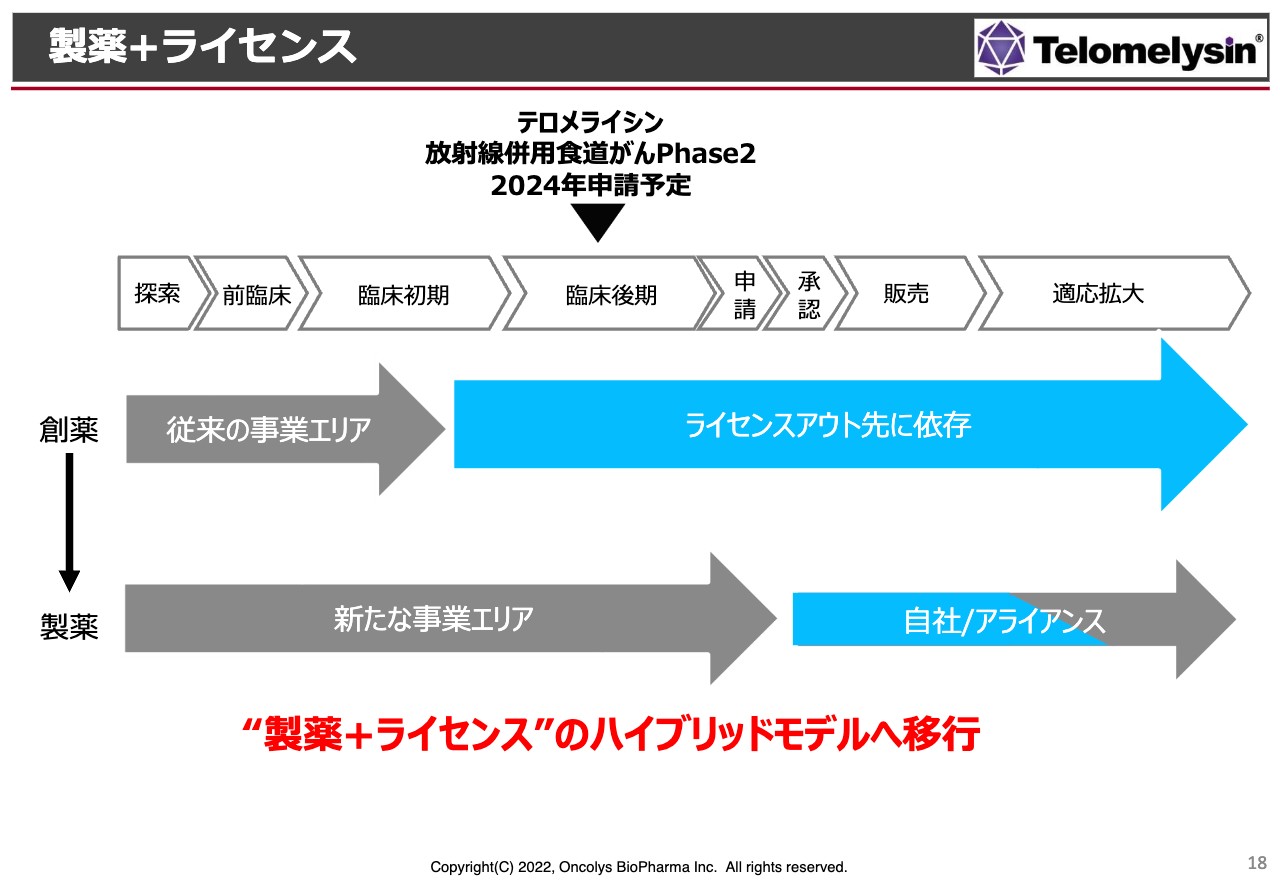
こちらについては、先ほど「POST中外」でお話ししたとおりです。
国内のテロメライシン市場
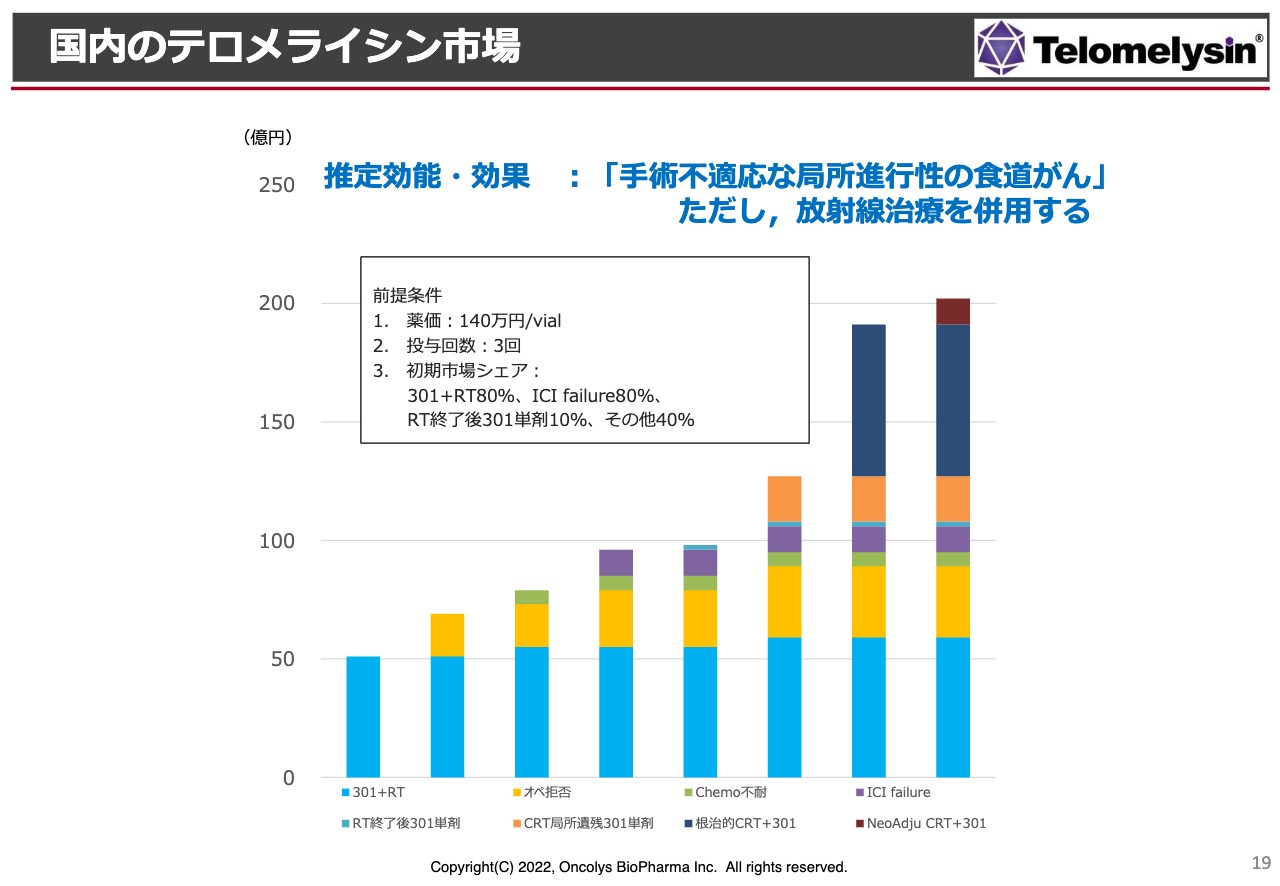
「テロメライシン」のマーケットに関してはいろいろな見方があります。少なくとも放射線を併用してほしいと添付文章に書かれるため、特に「手術不適応な局所進行性の食道がん」が対象になっています。
このような症例というのは食道がんのだいたい5パーセントから8パーセントくらいになりますので、それほど多い患者数ではないと考えています。食道がんの発症率は毎年だいたい2万数千人ですので、適応になるのは1,500人から2,000人程度ということです。
薬価については、スライドに「140万円/vial」と書きましたが、これはあくまで先行している「デリタクト」という、ヘルペスウイルス製剤で脳腫瘍に対する薬を参考にしています。
こちらと同じ薬価が付くかどうかはまだわからないものの、これと同じような薬価が付いた場合には、早めにピークセールスに持っていきたいと思っています。
マーケットを実際に調査した場合には、オペを拒否する患者さま、あるいは「ケモセラピー、化学療法は避けたい」「毛が抜けるのが嫌だ」という方も多々いらっしゃるようで、将来的にはそのような方が適用になってくるだろうと考えています。
このようなことを考えると少しゆっくりした計画ですが、きちんとした製薬メーカーと組んだ場合には、だいたい発売して3年目にピークセールスまで持っていきたいと考えています。だいたい150億円から200億円の間くらいに持っていきたいと考えています。
その後、先ほど効能追加というものがありましたが、ケモラジに上乗せ、併用ができるような効能追加ができるようになれば、この売上というのはおそらく1.5倍から2倍に膨れていくだろうと期待しています。これが「テロメライシン」のフォーキャストです。
OBP-2011 ハムスターモデル実験
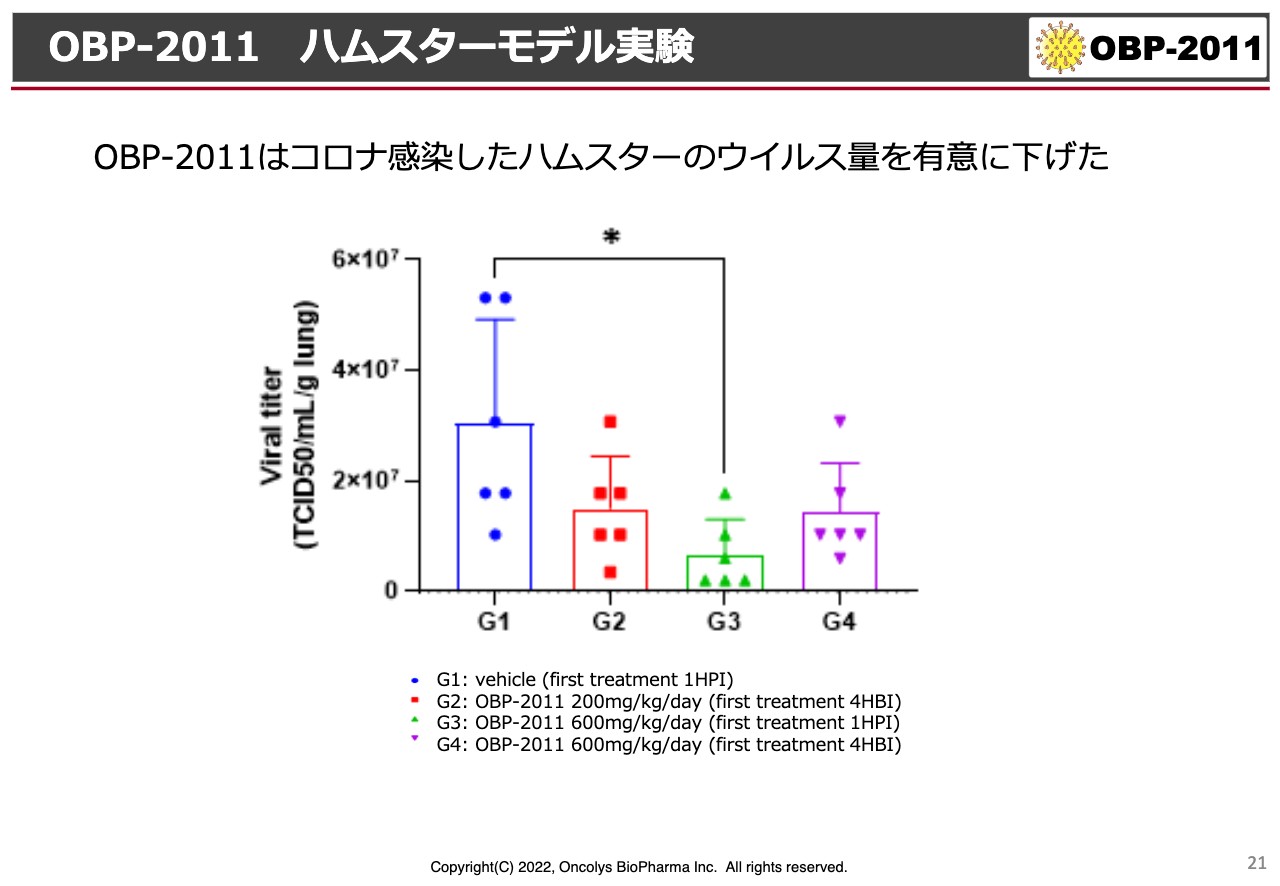
新型コロナウイルス治療薬についてです。新型コロナウイルス治療薬については、株主総会でもお話ししましたが、ハムスターのモデル実験において「OBP-2011」がウイルス量を有意に下げるという結果が出ました。ただし、スライド下に記載のように、投与量が非常に高く、600mg/kgという薬医学的に見るとかなり高い量で結果を出しています。
しかし、許可になっている「パクスロビット」はファイザーの薬ですが、これも同じような実験をするとだいたい300mg/kgくらいでようやく効果が出るという結果です。この600mg/kgというのは、確かにメルクの「モルヌピラビル」よりは弱いという結果ですが、臨床ではどうなるかの予想がなかなかつかなかったという結果になっています。
今後、先ほどお話ししたとおり、これは経口投与しているのですが、もう少し肺で効かせるということを考え、吸入剤などの他の薬と違った投与形態でマーケットに残れるかどうかを検討していきたいと考えています。
OBP-2011 ヌクレオカプシドタンパク質阻害剤
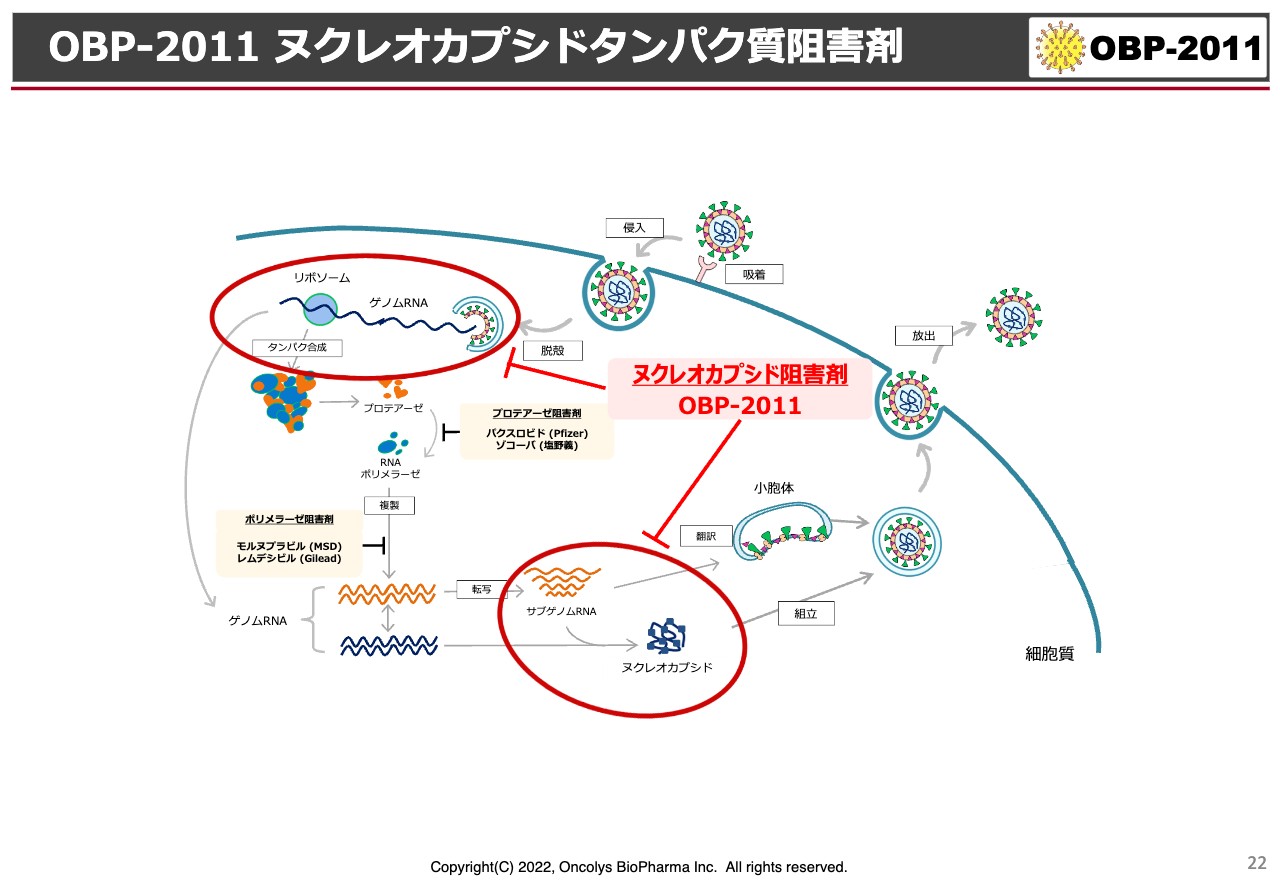
現段階では、この「OBP-2011」のメカニズムはスライドの図のとおり、上から新型コロナウイルスが侵入してきて、これがどんどん増殖に向かうのですが、最初の脱殻と言いますか、ゲノムとRNAが分かれるところと、あるいは右下に書かれているような、プロテアーゼやポリメラーゼの影響を受けてタンパクとRNAが結合し、もう1回ウイルスができるところの両方に作用しているのではないかと考えられています。
しかし、もう少し詳細なメカニズムがわからないと、製薬メーカーは「これをやりましょう」というところまでは、なかなか進んでいただけない状況です。
今後の開発方針

現段階では当面、鹿児島大学あるいは国立感染症研究所との研究を行っていきたいと考えています。できる限り年内に標的タンパクの特定を行いたいと思っています。このようなことが可能になる、あるいは吸入するような実験系が組めることになったら、筑波大学でもマウスを使った実験をしたいと思いますが、これには少し時間がかかる予定です。
このような状況ですが、昨今みなさまもご存じのように、塩野義製薬の経口コロナ治療薬の緊急承認が日本で見送られたということが報道されています。このようなニュースを聞き、当社も「コロナ治療薬の承認ハードルがかなり高くなっている」と、なおかつ国がメルクやファイザーから経口剤もたくさん購入しているということで、「若干、緊急性も低くなっているのではないか」と考えざるを得ない状況になっています。
このようなことから、今後「OBP-2011」の開発は優先順位を引き下げますが、メカニズムの解明等はしっかり進めていきたいと考えています。
レトロトランスポゾンとは
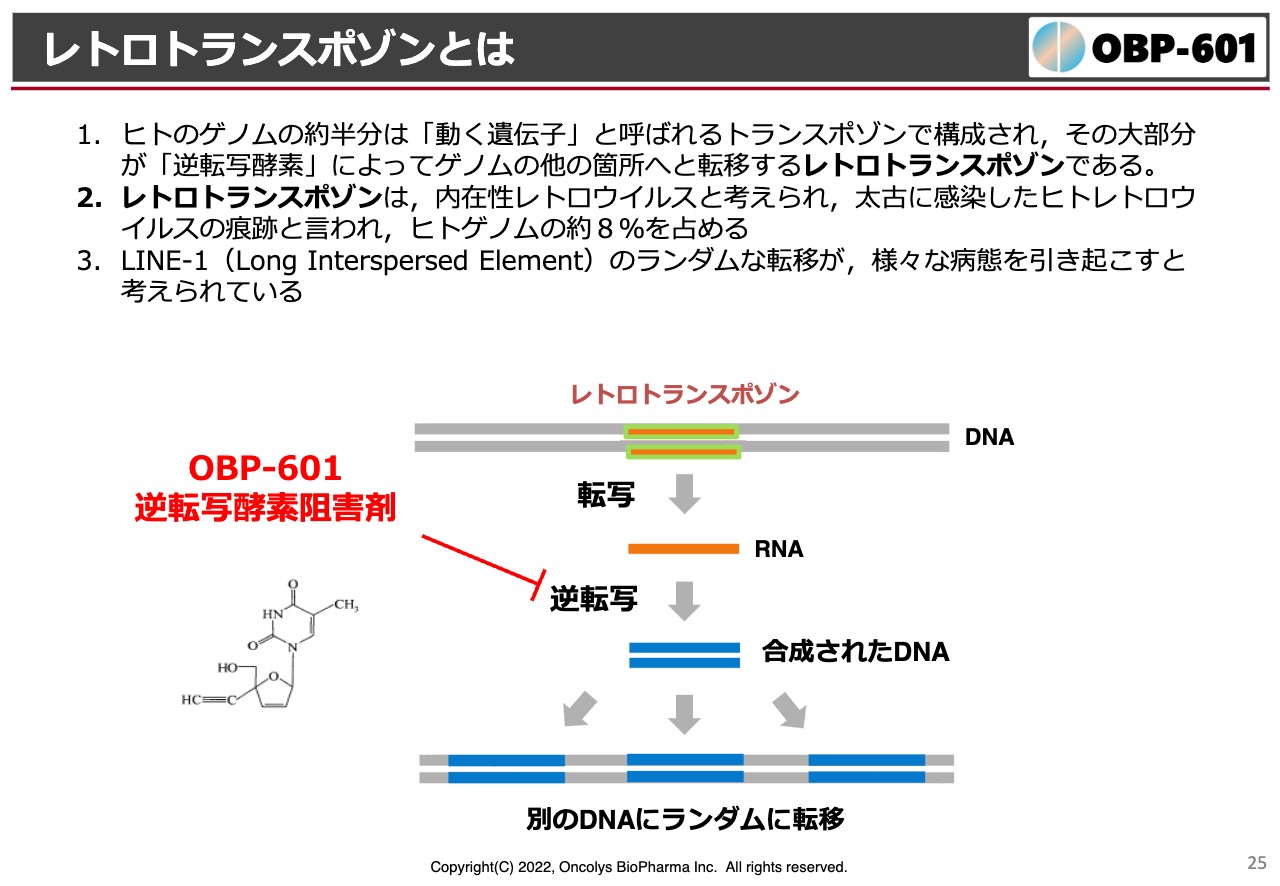
続いて「censavudine(OBP-601)」の状況です。こちらも冒頭でお話ししたように、抗エイズ薬として開発していたものをTransposon社にライセンスアウトして、神経難病に効かせようということです。
我々のゲノムの中にはレトロトランスポゾンという、太古の先祖の頃にたくさんのウイルスに感染する中で、エイズのようなウイルスに感染したゲノムの残滓が入っています。このようなものが、我々の体内にある逆転写酵素の活性化によってあちこちに飛んでしまい、それによってゲノムが本来の目的と違った働きをしてしまうことになります。
開発の着眼点
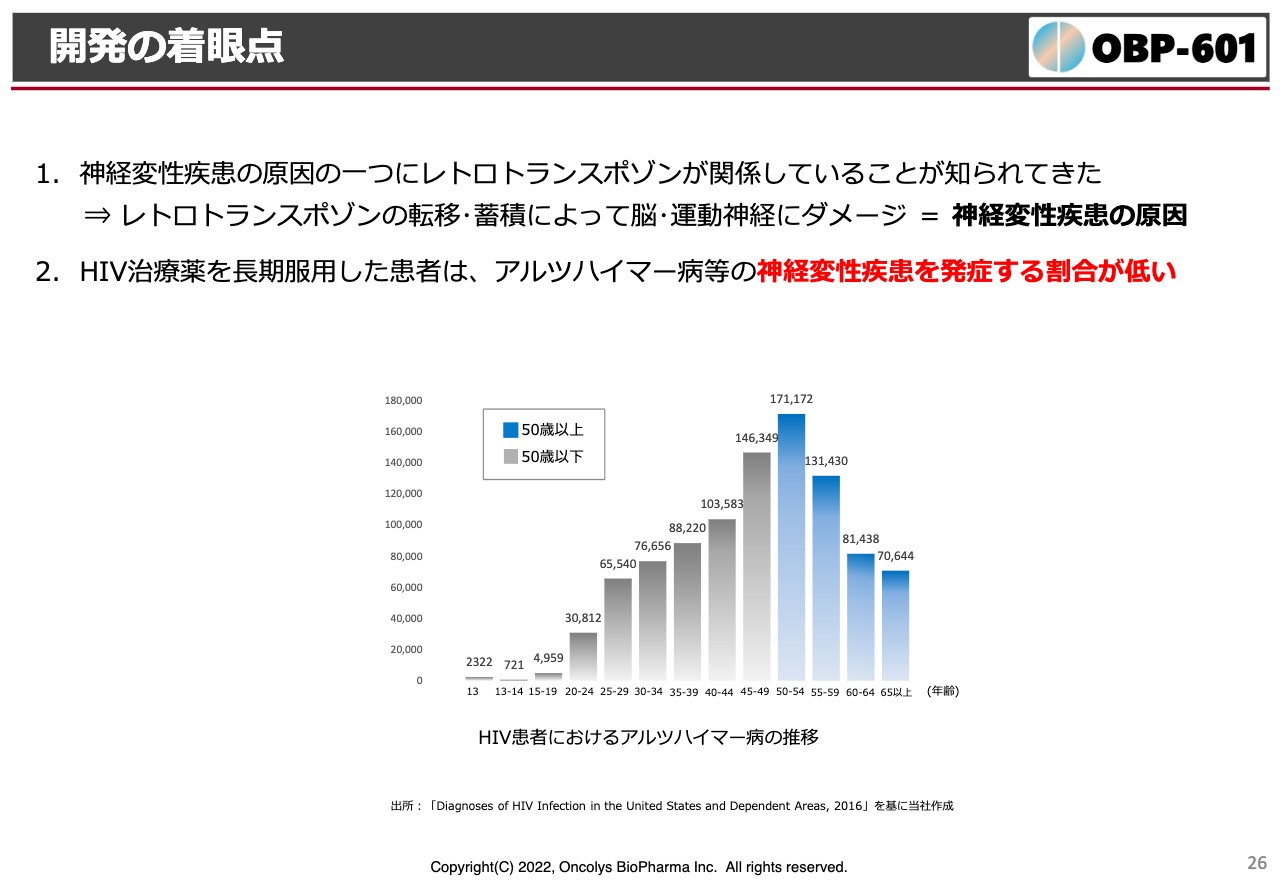
これを抑制できればよいのではないかという発想から、ブラウン大学やアメリカでのいろいろな疫学においても、HIVに感染したアルツハイマー病の患者さまは、逆転写酵素阻害剤を一生飲み続けるわけですが、高齢になるにしたがってアルツハイマー病の発生率が低くなることがわかっています。つまり、抗エイズ薬を飲んでいる方はアルツハイマー病になりにくいという疫学調査があります。
OBP-601の特徴
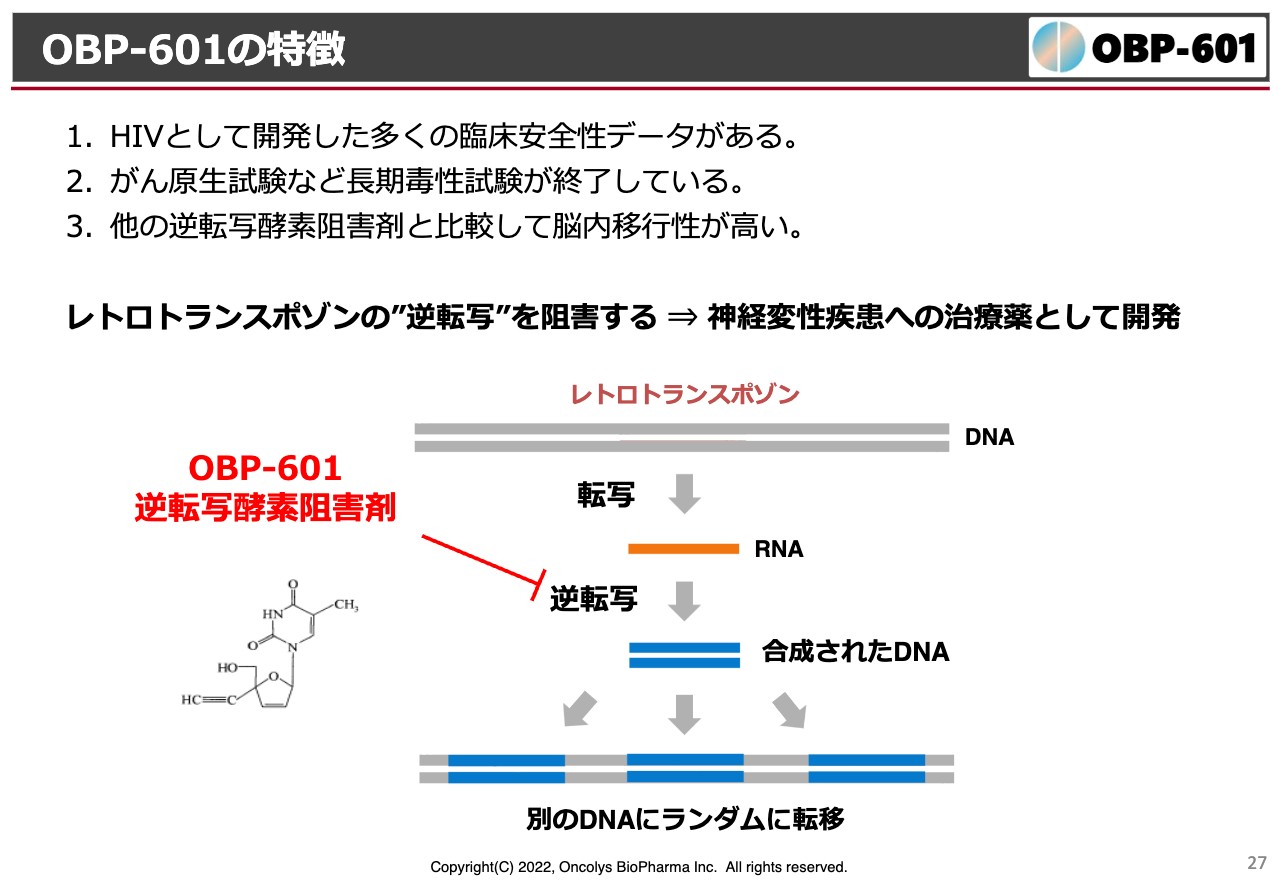
このような情報から、当社はこの「OBP-601」を、アルツハイマー病に限るのではなく、もう少し広く、神経難病に対してのオーファン領域でなんとか許可を取れないかということで、今狙いを定めています。
ライセンスと開発状況

2020年にTransposon社との契約を行いましたが、契約総額は現在で390億円くらいになっています。現在、「Phase2a」の臨床試験がアメリカとヨーロッパの複数の施設で行われており、PSPで40例を目標に、すでに半分以上の組入れが終わっています。その下に記載のALSとFTDでも、40例を目標にして、現在欧米で臨床試験の組入れが行われています。
トップラインの情報がいつ頃になるかについてですが、Transposon社からの情報によると、これは長期のフォローが要りますので2023年末までにデータを固定して、2024年にトップラインの結果が出てくるとうかがっています。
OBP-601 市場性
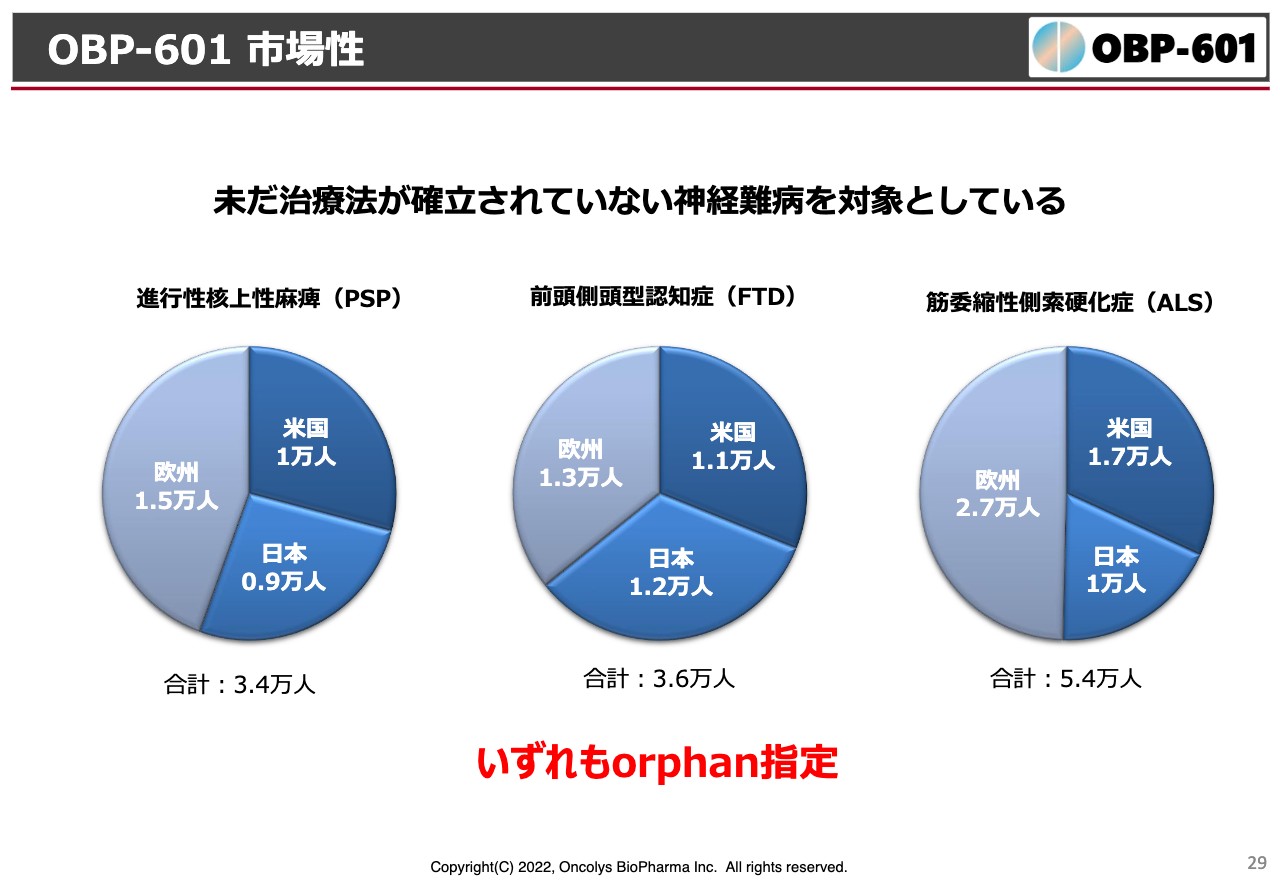
ただ、患者数においてはPSP、ALSいずれも日本では1万人前後、世界的に見てもそれぞれ3万人から5万人くらい、全世界で十数万人くらいが対象になるということで、いずれもオーファン指定を受けているような病気です。もちろんこれらで効果が出れば、当然アルツハイマー病にも向かっていきたいと考えています。
2022年~23年のカタリスト①
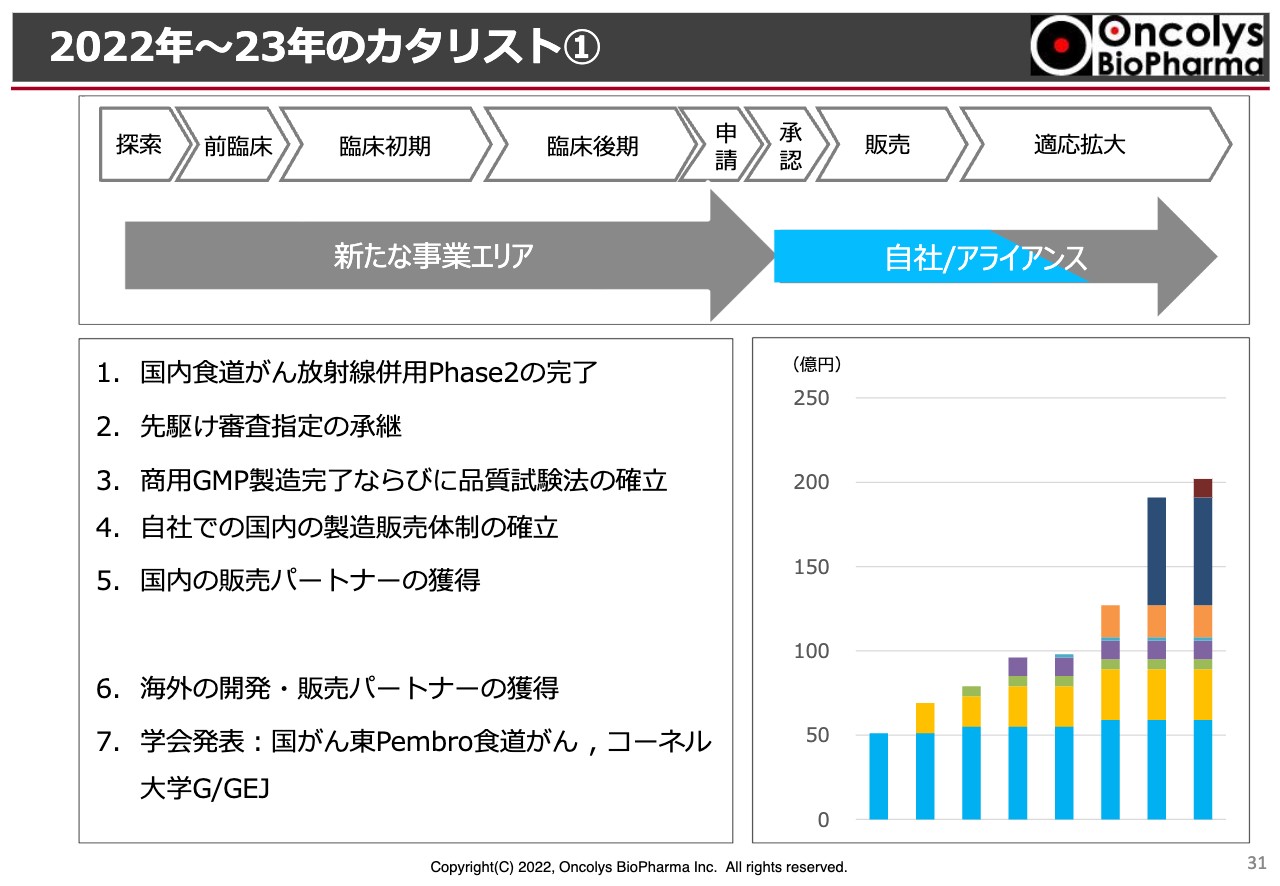
最後になりますが、今後の主なカタリストという項目を設けています。当然、当社のトップラインのパイプラインは「テロメライシン」です。先ほどお話ししたように、当社独自で承認申請を行っています。その後の販売、適応拡大においては、製薬企業と組んでいきたいと考えています。コ・プロモーションになるのか販売委託になるのかわかりません。ただ、効能追加は必須だと思っています。
このようなところから、パートナーの獲得は当然行っていきますし、これからは製造販売体制を当社が独自で確立していくということで、これまで研究開発型からは、今後は製薬メーカーになっていこうという決断をしています。そのために全力投球していきたいと考えています。
GMP製造についても、現在は非常に順調です。今後もすべて順調にいくかどうかはまだわかりませんが、最初にGMPに移る前の大きなマッチングにおいては終了し、品質においてもよい結果が得られているという報告を受けています。
2022年~23年のカタリスト②

他のパイプラインについてもお話ししたとおりです。2022年から2023年において、「OBP-601」は全症例の組入れが完了してフォローアップに入っていること、「OBP-2011」またはコロナ治療薬については、メカニズムがわかって新たな製薬メーカーとの共同開発体制が取れていることを目指しています。
「OBP-702」については、来年3月から新たな臨床試験用のAMED助成金にチャレンジします。それが通れば、臨床試験は2023年には治験届を申請するくらいまでは進んでいるのではないかと考えています。「OBP-401」もプラットフォームが確立していることを目指していきたいと思っています。
オンコリスの目指す姿
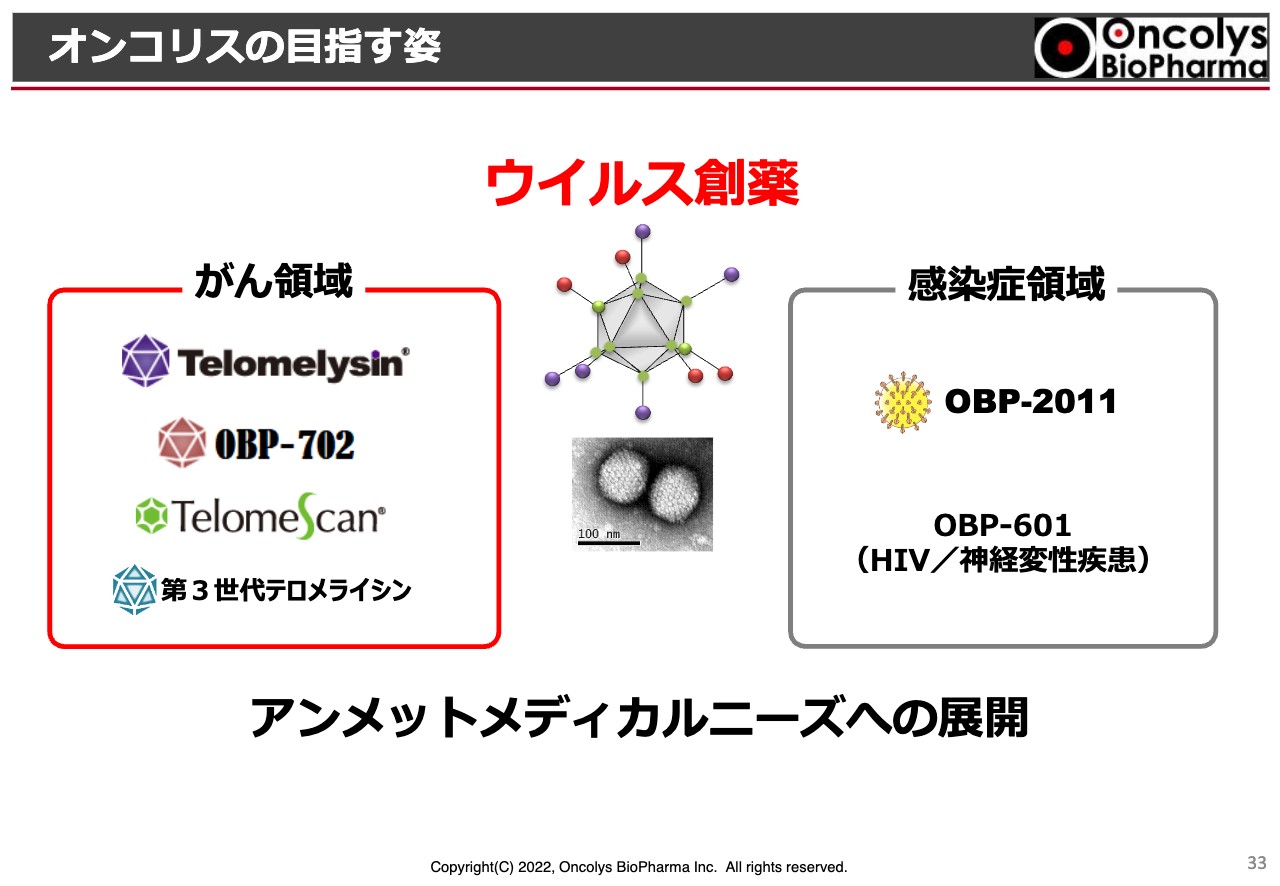
当社はこれまで創薬メーカーでしたが、今後はウイルス創薬およびウイルス製薬メーカーになっていきたいと考えています。がん領域あるいは感染症領域で、すべて「ウイルス」というキーワードを用いて開発を行い、特にアンメットメディカルニーズを埋めていきたいと考えています。
以上でプレゼンテーションを終わらせていただきます。ご清聴ありがとうございました。
質疑応答:「テロメライシン」の日本での先駆け指定について

質問:「テロメライシン」に関して、日本での食道がん対象の先駆け指定の放射線併用療法の組入れ状況、およびそのトップラインデータの発表時期について教えてください。
浦田:先ほどお話ししたとおり、本日も内視鏡の判定委員会というものが行われていますが、当社はこの中には入れません。とはいえ、かなりの症例数が進んでいき、今判定されています。あと本当に数例というところまできているのですが、トップラインデータができるのは、この試験のデータがロックされる時です。
仮に最終症例が組入れられたとすると、その後フォローアップが行われることになります。それを考えると、来年の秋くらいにトップラインの報告ができるのではないかと考えています。
質疑応答:ヘノジェン社でのプロセスバリデーションについて

質問:ヘノジェン社におけるプロセスバリデーション作業の進捗状況について教えてください。
浦田:ヘノジェン社では小規模のテストランを3回ほど繰り返し行っています。これまで当社はロンザ社という会社に委託した合成樹脂を使ったバッグを使って製造してきたわけですが、今後は大量製造も見据えるためのタンクを使って製造していくということです。
製造方法は基本的に変わらないのですが、バッグからタンクに移したことによって、例えば細胞、ウイルスの状況が若干変わることもあります。現段階では実製造の50リットルタンクで成功していますので、今後はできる限り、年内を目標にしていますが、GMP製造まで持っていって、来年には商用製造ができるというような状況が見えてきたところです。
一方で、品質管理はまだバリデーションの最中です。こちらも来年の早い時期にすべてのバリデーションを終え、きちんとした品質チェックができるようにしていきたいという計画です。
質疑応答:「テロメライシン」の次の導出・提携先について
質問:「テロメライシン」の次の導出・提携のターゲットと進捗状況についてコメントいただければと思います。
浦田:これまでお話ししてきたように、「テロメライシン」は日本と海外では若干状況が違ってきており、日本は先駆け指定のもとに、もうすでに承認申請の体制に入っています。日本国内でのライセンスということには当然チャレンジしていきますが、むしろ共同販売提携先を優先的に探していきたいと考えています。
ただし、その提携先に効能追加の臨床試験まで一緒に行っていただけるかどうかはまだ未確定ですので、将来的には効能追加、いわゆる販売の拡大ができるような会社と、可能であれば組みたいと考えています。
一方でアメリカですが、こちらも先ほどお話しした胃がん、あるいは胃食道接合部がんのコーネル大学を中心に行っている臨床試験がよい結果で終わっていった場合には、チェックポイント阻害剤などを開発しているメガファーマには少しインパクトがあると考えています。
すでにメガファーマと新しい臨床試験計画、あるいは共同開発計画のレジュメを作り、今年の夏から秋にかけて、アメリカで共同提携の話し合いをする状況にきています。当社もどんどん介入していき、できる限り大手と組めるようなビジネス活動を展開していきたいと考えています。
質疑応答:「OBP-2011」の開発成果の活かし方について
質問:経口コロナ治療薬「OBP-2011」について、AMEDの公募で不採択になり開発の優先度を下げるということですが、感染症のメカニズムのことなどもありますので、治療薬候補を増やしておく意義はあると思います。今回の開発の成果を中長期的にどのように活かしていくのかについてコメントをお願いします。
浦田:我々も新型コロナウイルスが第7波まで来るとは思っていませんでした。世界的に見ても今一番、日本で患者さまが増えているようですが、このような状況を見て、世界的にこれからまだ何かあるかもしれないと考えています。
ファイザーの薬についても、アメリカのバイデン大統領が「その薬で治療した。だから、再度感染した」といったように、治療を行った患者さま特有の再感染も報告されています。
そのようなことをなくすことも含め、当社の新しいメカニズムは高い評価を受けてきました。ただし、「メカニズムはおそらくこのあたりだろう」というところまでわかっているのですが、「このタンパクのここを阻害している」「ここをブロックしている」ということはまだわかっていません。これについて非常に細かくデータを取りながら見ています。
このようなことがわかってくれば、例えば先ほどお伝えしたとおり剤形を変えて、喘息の患者さまが使う吸入剤や鼻詰まりの時に鼻にスプレーする薬のように投与できないか、もしくはもう少し大手の力を借りて1日1回投与でさらに少量で済む剤形が組めないかなどを一緒に考えていただけるパートナーと組みたいと思っています。そのためにも、まずメカニズム解明が重要だと判断しています。
質疑応答:「テロメライシン」の新規販売パートナー選びの見通しについて
質問:「テロメライシン」の新規の販売パートナー選びの見通しについて教えてください。中外製薬との提携解消はネガティブな印象となりましたが、今交渉しているパートナー候補は「テロメライシン」のどのような点を評価しているのでしょうか?
浦田:中外製薬との契約解消は、いろいろな会社とお話ししていてもポジティブに捉えられないことは確かですが、かといって非常にネガティブなことでもありません。製造がうまくいくかどうかは当然製薬メーカーの注目の的であり、我々も人材や資金を投下して、しっかりした製剤を作っていこうと努力しています。今はまだ共同開発までは進んでいませんが、共同販売について内資・外資を含めた数社との話し合いを行っています。
また、製造がしっかりできるとなった場合に、次の問題はマーケットになります。先ほどお伝えしたとおり、我々はできる限り3年の間にピークまで持っていくことで150億円以上のセールスが見込めるのではないかと考えています。すでにいろいろな臨床医ともお話ししており、製薬メーカーにも臨床医の考え方をフィードバックしています。
「もし本当に許可が取れるくらいになったら、多くの患者さまに使っていきたい」「切るよりは薬で治したい」という先生方も多々いらっしゃいますので、そのようなところでマーケットを展開できると考えています。
話し合いを続けている製薬メーカーとは、もう少し詳細なところまで突き詰めていきます。承認申請まではまだ時間がありますので、できれば来年の株主総会までに会社をしっかり絞っていきたいと思っています。
それ以外にも、いわゆるデリバリーの卸業者についてもしっかり取り組まないといけない状況です。再生医療品などのデリバリーも随分いろいろなことができるようになってきましたので、すでに卸業者との話し合いも始めています。
質疑応答:「テロメライシン(OBP-702)」の開発見通しについて
質問:次世代「テロメライシン(OBP-702)」の今後の開発の見通しについて教えてください。
浦田:「OBP-702」は岡山大学で精力的な研究活動が行われており、今年から来年にかけてまたいくつかの論文が出てきます。特に「OBP-702」の特徴である「p53」というがん抑制遺伝子をがん細胞の中で作ると、大変強力な活性が出てくることは相変わらずです。
しかし、その他にもがん組織を取り巻く「CAF(cancer-associated fibroblast)」という繊維芽細胞に対しても「OBP-702」は効果があるという結果も出ています。線維芽細胞は非常にリッチで薬が効かないのですが、そのような意味では膵臓がんや卵巣がんなどにも効くことがわかってきました。
我々も資金があれば開発をどんどん進めたいと思っています。現段階ではAMEDから比較的高い評価を受けており臨床開発まで持っていける可能性が出てきましたので、少なくともAMEDの科学研究費を用いてできる限り前に進めていきたいと考えています。
「Phase1」に入れる臨床試験などの結果が出てくれば、ライセンスが可能になってくると思います。現在いろいろな製薬メーカーが腫瘍溶解性ウイルスを評価していますので、やはりモノだけではなく、臨床結果が出てきてからのライセンスになると思います。
質疑応答:研究開発費の見通しについて
質問:今後の研究開発費の見通しについて教えてください。各パイプラインの進捗状況によって変わってくるかと思いますが、2023年12月期の研究開発費の規模感についてお願いします。
吉村:各パイプラインの進捗状況によって変わってきます。特に今期は中外製薬に一部負担していただけるという前提がありますので、可能な限りCMCの製法開発費用を前倒しで開発を進めているため、今期は非常に多額の開発費を予定しています。
そのため、今期と比較すると来期はかなり減少していくと見込んでいます。具体的な金額は精査中ですので、今お伝えすることは差し控えさせていただきたいと思います。
質疑応答:「テロメライシン(OBP-301)」の研究開発費について

質問:「テロメライシン(OBP-301)」の上市に向けた製法開発の費用として、2021年1月から2024年12月まで26億4,000万円ほど投資するということですが、こちらは製法開発のみに使うのでしょうか? それとも、放射線併用の食道がんの臨床試験の費用としても使われるのでしょうか?
吉村:製法開発です。
浦田:臨床試験の組入れはほとんど終わりましたので、あとはデータベースに入れて患者さまをフォローし、承認申請用にデータパッケージを作っていく作業になります。ですので、来期の臨床試験の経費は、他のものにたくさんお金を使わない限りはかなり減っていくと考えています。
質疑応答:「テロメライシン」の販売体制について
質問:「テロメライシン」の販売について、「コ・プロモーションか販売委託かはわからない」というご説明がありましたが、この判断をいつ頃までに行う考えでしょうか? また、コ・プロモーションの場合は、MRは何人程度を想定しておけばよいでしょうか?
浦田:この判断は急を要していると思います。我々は2024年の比較的早い時期に再生医療等製品の製造販売業の許可を求めていきますが、それまでには製造販売体制を作りたいと考えています。
最初の段階では「我々独自で販売します」ということで業務の許可を取るのですが、それまでの間にしっかりとセールスフォースを作るのはなかなか容易ではない状況です。我々はコ・プロモーションにしたいと考えていますが、相手先によっては販売委託になる可能性も否めないと思っています。
ただし、コントラクトセールスが使える状況になっていますので、どちらが効果的かという評価を進めているところです。
現在、臨床試験を行っているのは日本で17施設です。今後それをどのように広げていくかというところがあります。特に「テロメライシン」は内視鏡で投与するため比較的難しく、また食道がんで初めてのウイルス製剤ということもあり、いきなり国内何百施設でたくさん使っていただくことはなかなか難しいのではないかと考えています。また、そのようなことを行うと予期せぬ副作用が出てくる可能性もあります。
そのため、発売直後はできる限り限られた臨床施設で使っていただき、きちんと評判が出て学会でも認められる状況になれば、施設数を増やしていきたいと思っています。
3年後にはピークセールスを目指すということで急激に増やしていきますが、ピークの段階では10人以上のセールスフォースが必要と考えています。これを自社独自で行うかは、もう少し精査したいと考えています。
質疑応答:「OBP-601」の現在の開発状況について

質問:ライセンスアウトが完了している「OBP-601」の現在の開発状況について、追加でご説明をお願いします。
浦田:Transposon社からあまり詳細に話さないでほしいと言われていますが、先ほどお話ししたスライドをもう一度ご覧ください。今、臨床試験が2つ進行中です。PSPは40例が目標で、すでに半数以上が組入れられています。ALS/FTDは40例が目標で、まだ半数には届いていません。
こちらの臨床試験は6ヶ月以上フォローしなければならないため、組入れが終わってトップラインデータが出てくるのは2024年になるのではないかと予想しています。新型コロナウイルスの影響で、残念ながらALS/FTDの組入れは若干スピードがダウンしましたが、PSPはかなりスピードアップしています。
ただし、こちらはプラセボ対象の二重盲検比較試験ですので、「どのくらい効いているか」などの中間的な報告は一切できないことをご理解いただきたいと思います。
質疑応答:「テロメライシン」のライバル候補について
質問:「テロメライシン」のライバル候補について教えてください。ノバルティスの抗PD-1抗体「チスレリズマブ」と化学療法による食道の扁平上皮がんに対する「Phase3」試験では、OSが化学療法のみを7ヶ月ほど上回りました。ファーストライン対象の抗PD-1抗体ですが、OSの延長だけでは「テロメライシン」のライバルにはならないと考えていてよいのでしょうか?
浦田:「テロメライシン」をどのような薬と捉えるかによります。もちろんノバルティスとはアメリカでもう1回お話しする予定です。
ノバルティスの臨床試験やBMSの「ニボルマブ」もそうですが、ステージ4の方が中心になっています。将来的にはステージ3やステージ2の方にも使える状況にはなっていくと思いますが、「テロメライシン」の位置付けの一番特徴的なところは、先ほどお伝えしたとおり、食道が完全に詰まってしまい食事がとれないという患者さまが対象です。
例えば、ノバルティスのデータやMSDの「ペムブロリズマブ」、BMSの「ニボルマブ」もそうですが、チェックポイントと化学療法だけでは食道の局所の詰まりを全部取ることはできず、かなり残ってしまいます。
そのようなところに「テロメライシン」を投与し、いわゆる「QOLをより上げる」という方策はまだ十分にあると考えています。したがって「ペムブロリズマブ」「ニボルマブ」やノバルティスの新しい抗PD-1抗体との併用は可能性があると考えています。
ただし、OSを伸ばすなどのエンドポイントになるかどうかは、メーカーといろいろお話しする必要がありますが、QOLについて評価すればまた違った結果になるのではないかと思っています。
質疑応答:「テロメライシン」の学会発表予定について
質問:「テロメライシン」の学会発表予定について教えてください。先ほどご説明があった国立がん研究センター東病院での医師主導治験で、来年のAACRでの発表を計画しているとのことでしたが、そちらについてもう少し詳細をお願いします。
浦田:国立がん研究センターの研究グループはすでに臨床結果を発表してしまったため、大きな学会や論文にまとめていく上で、それ以外のプラスアルファが必要だというところで意見が一致しているようです。
血液サンプルや臨床から取ってきたいろいろなサンプルを分析した結果、「テロメライシン」治療で動くおもしろいバイオマーカーが見つかりそうだというお話を聞いています。そのような新しい発見があれば、大きな学会や一流のジャーナルに投稿できます。そのようなことも含め、臨床試験の組入れも終わり、臨床データをフォローアップしている状況です。
また、国立がん研究センターは名古屋大学と組んでいますが、名古屋大学での基礎検討はマーカーと有効性をつなぐ結果になると思います。このようなものをすべて含めた上で、学会発表やジャーナルへの投稿に持っていきたいと先生方は考えているようです。
質疑応答:中国市場への取り組みについて
質問:食道がんは中国が最大のマーケットと言われています。中国市場への取り組みについて、どのような方針なのか教えてください。
浦田:これまで中国へのアプローチを進めてきていることは、みなさまにもお話ししてきました。ただし、データがなかなかまとまりませんでした。
特に中外製薬との契約解消の影響が大きいです。我々は中外製薬が中国市場をカバーしてくれると考えて今まで進めてきましたが、それもなくなった段階で、新たに中国市場へ働きかけています。
ただし、承認申請の最終段階に来ているということで、中国の製薬メーカーは「『Phase2』の結果を見て、その結果によってライセンスを考えたい」というところがほとんどです。
現段階では「すぐに契約締結しましょう」という状況から少し退いたかたちではありますが、今日も当社のビジネス部門は中国の会社と電話会議などを行っていますので、可能性がまったくゼロになったわけではありません。我々のデータをもう少しじっくりと積み重ねていき、中国へのライセンスに結びつけていきたいと考えています。
スポンサードリンク

