関連記事
理研など、がん細胞からゲノム変異を活性化させる“スイッチ”を高感度に検出
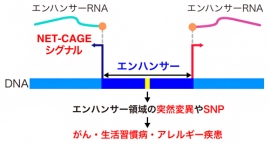
NET-CAGE法による疾患メカニズムの解明(画像: 理化学研究所の発表資料より)[写真拡大]
理化学研究所、ダナフォーム、京都大学は3日、“遺伝子の発現スイッチ”として働く「エンハンサー」を高感度で検知し、さらに活性度を測定する技術の開発に成功したことを発表した。この技術により、発病因子となるゲノム変異の解析が進み、次世代ゲノム医療に活用されることが期待される。
【こちらも】理研、アトピー性皮膚炎の原因遺伝子の解明
エンハンサーは、遺伝子の転写効率を上げるDNA領域である。これまでの研究で、一連の遺伝子発現の変化に先行して、エンハンサーが活性化する現象が確認されており、遺伝子の発現調節で重要な役割を担っている。
エンハンサーの突然変異には、がん、生活習慣病、アレルギー疾患など、さまざまな病気の発症と関連性があることが報告されている。そのため、ヒトゲノムのどこにどれだけのエンハンサーが存在し、それらがどのように活性化されるか、といった詳細の解明が急務とされてきた。
エンハンサーを同定・定量する技術としては、ChIP-seq法とCAGE法が知られている。しかし、ChIP-seq法はゲノムワイドに解析する方法であるため、一塩基レベルの高分解能での同定ができないという問題があった。一方CAGE法では、細胞内にごくわずかに存在するeRNAのシグナルを捉える必要があるため、活性化エンハンサーの同定感度が低く、動作メカニズムなどの詳細までは明らかにできないという課題があった。
そこで、今回開発された技術では、細胞内のトータルRNAではなく、新しく合成している最中の新生RNAに注目した。新生RNAにはeRNAが高い割合で含まれているため、CAGE法を効率的に用いることができるのである。そして、新生RNAを迅速かつ高純度に回収・精製する手法を開発し、これとCAGE法とを組み合わせて「NET-CAGE法」と名付けた。
NET-CAGE法では、従来のCAGE法に比べて飛躍的にエンハンサーの検出感度が向上。また、簡便な手順で多くの検体の解析が可能で、凍結保存した細胞や組織に対しても適用できる。
NET-CAGE法を5種類のヒトがん細胞株(白血病細胞、リンパ芽球細胞、乳がん細胞、子宮頸がん細胞、肝がん細胞)に適用したところ、約3万の活性化エンハンサーが、一塩基レベルの高分解能で網羅的に同定された。また、エンハンサーは特定の細胞に対して特異的に活性化することも分かった。
個体発生や疾患発症に中心的な役割を担うエンハンサーには、病気のゲノム変異が濃縮されている。そのため、今回開発された新たな解析技術によりもたらされる知見が、今後のゲノム医療の推進に大きく貢献することが期待される。
スポンサードリンク
