関連記事
酢酸が腸内細菌コントロールの助っ人として働く仕組み解明 理研ら
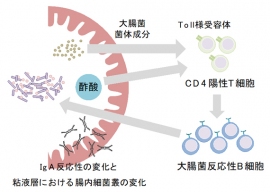
酢酸がIgAの腸内細菌反応性のバランスを変化させて腸内細菌を制御する仕組み。(画像: 理化学研究所の発表資料より)[写真拡大]
酢が健康にいいということを人類は経験的に知っており、紀元前より利用してきた。理化学研究所らの研究グループは15日、腸内の酢酸が免疫を誘導し、大腸菌などの病気の元になる菌のみを捕まえ、粘膜内への侵入を阻止することを明らかにしたと発表した。酢酸は腸内細菌により作り出されており、今後腸内細菌をコントロールすることで、病気の予防や治療につながることが期待される。
【こちらも】寄生虫が体重増加を抑制 群馬大などの研究
今回の研究は、理化学研究所の竹内直志研修生、大野博司チームリーダーらの国際共同研究グループにより行われ、14日のNatureオンライン版に掲載された。
我々は、約100兆個、1000種類の腸内細菌と共生している。個々人の生活習慣や健康状態などにより、共生している細菌はそれぞれ異なっている。これらの細菌の中には人によい働きをするものもあれば、病原菌などとして悪い作用を及ぼすものもあり、そのコントロールは重要だ。近年では、その細菌の種類や状態が腸内だけでなく、糖尿病や神経の疾患、肥満に影響していることも明らかになってきている。
腸内細菌は、代謝の過程で酢酸などの短鎖脂肪酸を作り出す。短鎖脂肪酸とは、酢酸、酪酸、プロピオン酸など分子の小さな酸のことだ。この短鎖脂肪酸が免疫細胞の働きに影響を与えていることが、だんだんと明らかになってきていた。
今回研究グループは、短鎖脂肪酸が腸内の免疫の機能にどのような影響を与えているかを調査。免疫のうちIgAは主に腸管の粘膜から分泌されている抗体である。このIgAが腸内細菌のコントロールに関与していると考えられているが、そのメカニズムは明らかになっていなかった。
研究グループは、マウスに「短鎖脂肪酸付加セルロース」という飼料を与え、大腸中での短鎖脂肪酸の濃度を高くした。すると、短鎖脂肪酸の一種である「酢酸」が付与されたセルロース(酢酸セルロース)を与えられたマウスでは、IgA産生細胞やIgAが増加し、さらに腸内細菌への結合率も高くなっていた。一方、プロピオン酸や酪酸を付加したセルロースでは、このような効果は認められなかった。
そこで酢酸セルロースの有無がIgAにどのような影響を与えるかを調査するため、酢酸セルロースを与えたマウスと与えていないコントロール(対照実験)マウスで、そのIgAを比較。すると酢酸セルロースマウスのIgAは、選択的に大腸菌などの病原性を持つ共生細菌に強く結合することが判明。
次に大腸菌と腸内共生細菌で、IgAにどのような違いが見られるかを調べた。無菌マウスの大腸に大腸菌を定着させたマウスと、一般的な腸内共生細菌を定着させたマウスを作成し、酢酸セルロースを投与。すると、大腸菌定着マウスのみでIgAが増加していた。つまり、大腸菌と酢酸セルロースが共に存在するときに、IgAが増加することが分かったのだ。
さらにグループは、大腸表面の粘膜層に注目した実験を行った。通常のマウスに酢酸セルロースを与えると、粘膜層の腸内細菌の種類が変化したが、IgAを作れないマウスでは変化しなかった。つまりIgAの働きで腸内細菌の組成が変化すると考えられたのだ。蛍光で光る大腸菌を用いてIgAの働きを検討したところ、IgAは大腸菌が大腸粘膜層に侵入するのを阻止していることが分かった。
これらの研究の結果、大腸菌などの体に必要でない細菌(病原性片利共生細菌)が侵入すると、酢酸の働きでIgAが腸内に増加し、細菌が腸の粘膜層に侵入して定着すること防ぐことが分かった。このようにして、安定した腸内細菌の状態が調節されているのだ。
さらに研究グループは、このIgA誘導のメカニズムを調べた。免疫細胞の1つであるT細胞について、試験管内での実験、およびT細胞を持たないノックアウトマウスを用いた実験を実施。その結果、酢酸と菌体が一緒にT細胞を活性化し、細菌をやっつけるIgAを増加させていることが明らかになった。
全身の病気にも影響しうる腸内細菌の制御のメカニズムを知ることで、今後の新しい治療法や予防法の開発につながって行くことを期待したい。(記事:室園美映子・記事一覧を見る)
スポンサードリンク
関連キーワード
