【東京薬科大学】病原細菌が多重な化学修飾により増殖の場を築く仕組み~非古典的ユビキチン化による宿主細胞因子の制御を発見~
配信日時: 2023-08-09 14:05:05

本研究のポイント
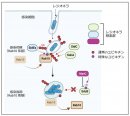
・病原細菌レジオネラは自身が持つ多様なユビキチン化酵素群の階層的な作用を介して、宿主因子Rab10を経時的に化学修飾することでレジオネラ液胞への係留を制御していることを見出した。
・それらの酵素群の一部はレジオネラの持つグルタミン転移酵素により特殊なユビキチン修飾を受け、その活性が抑制されることが分かった。
・その結果、感染初期にレジオネラ液胞に係留されたRab10は感染後期には液胞から乖離することが示された。
【研究概要】
東海国立大学機構 岐阜大学医学部の永井宏樹教授、久堀智子准教授らのグループと、東京薬科大学生命科学部の新崎恒平准教授は、共同研究により、病原細菌が宿主因子に多層的な化学修飾を与えることで経時的に増殖液胞の状態をコントロールする仕組みを明らかにしました。本研究では、これまでに知られていない特殊なユビキチン(注1)修飾が介在した制御機構が発見され、ユビキチンバイオロジーに新たな光が与えられました。
本研究成果は、日本時間2023年8月8日に生命科学・生物医科学分野のオープンアクセスジャーナルであるeLife誌のオンライン版で発表されました。
【研究背景】
人に重篤な肺炎を引き起こす病原細菌であるレジオネラは、感染宿主細胞内で働く酵素群を300種以上も保有するという他の細菌には見られない特徴を持っています。これらの酵素群の中には特に、「ユビキチン」という小さなタグをタンパク質に付与する「ユビキチン化」反応において、新規反応機構が多く見出されていることから、レジオネラは「ユビキチン研究の宝庫」と目されています。
レジオネラは細胞に侵入して細胞の中で特殊な液胞を構築し、それを生存・増殖の場としています。レジオネラが細胞内で増殖することが、感染宿主(ヒト)の発症の直接的要因となるため、増殖を引き起こすメカニズムの解明が感染防御の上で喫緊の課題となっています。レジオネラの細胞内増殖に関わる宿主因子の探索は世界中で広く行われてきましたが、近年、細胞内の膜輸送に関わる低分子量GTPアーゼ(注2)のひとつであるRab10の重要性が指摘されていました。Rab10はレジオネラ酵素によってユビキチン化され、レジオネラ液胞に係留されることが報告されていましたが、その詳細なメカニズムは不明でした。
【研究成果】
レジオネラが持つ古典的ユビキチンリガーゼ群SidCファミリー (SidC, SdcA, SdcB) のうち、SidCとSdcA は感染初期にレジオネラ液胞に局在し、Rab10をポリユビキチン化することが報告されていました。本研究により、そのユビキチン化の基盤となるのは、別のSidE ファミリータンパク質群 (SidEs) によるホスホリボシル化ユビキチン修飾(注3)という特殊な化学修飾であることが示されました。Rab10のポリユビキチン化は液胞にRab10が局在するという現象を伴って観察されたことから、ユビキチン鎖を介してRab10は液胞膜に係留されると考えられました。本研究ではさらに、感染後期にはSdcBがRab10のポリユビキチン化を促し、Rab10を液胞上に係留し続けようとすることがわかりました。
一方、別のレジオネラ酵素であるMavCはSdcBに対して特殊なユビキチン修飾を施すことが見つかりました。質量分析解析により、その修飾はMavCが持つトランスグルタミナーゼ(注4)(グルタミン転移)活性によってユビキチンのグルタミン残基がSdcBのリジン残基と共有結合した結果起こる特殊なユビキチン修飾であったことが明らかとなりました。この特殊な化学修飾によってSdcBのユビキチンリガーゼとしての本来の機能は損なわれ、結果として、感染後期にはRab10のポリユビキチン化は減弱し、レジオネラ液胞から乖離することが示されました。
【研究成果の意義と今後の展開】
本研究結果を通じて、古典的ユビキチン化反応に対してホスホリボシル化ユビキチン修飾がその介助をし、一方でグルタミン転移によるユビキチン修飾がその抑制に働くという、異なる3つのユビキチン化反応が多層的に作用するという構図が見出されました。このような多重制御があるために、レジオネラはターゲットである宿主因子の挙動を時間空間的に巧妙に操ることができると考えられます。このような複雑な仕組みは数多くの酵素を産生するレジオネラだからこそ実現できるものなのかもしれません。真核細胞にも多くのタンパク質ファミリーが存在し、分子構造のわずかな違いが異なる化学反応をもたらす例が多く知られていますが、微生物の生存戦略は人間の想像を超えた様々な化学反応によって支えられていることが明らかとなってきています。病原細菌の感染機構の解明を通じて、まったく未知の化学反応が今後も引き続き発見されると考えられ、それが感染防御や治療のための創薬に応用され、ひいては、ヒトを含めた真核生物のもつ免疫機構の解明にも結び付くことが期待されます。
【論文情報】
雑誌名:eLife
論文タイトル:Multi-tiered actions of Legionella effectors to modulate host Rab10 dynamics
(レジオネラエフェクターの多層的作用による宿主Rab10の局在操作)
著者:久堀智子a*, 新崎恒平b, 北尾公英a, 永井宏樹a,c* (*:責任著者)
a 岐阜大学大学院医学系研究科・病原体制御学分野
b 東京薬科大学・生命科学部・分子細胞生物学研究室
c 岐阜大学高等研究院・One Medicine トランスレーショナルリサーチセンター
DOI: https://doi.org/10.7554/eLife.89002.1
【用語解説】
(注1)ユビキチン:
76個のアミノ酸からなる小さなタンパク質で真核生物に普遍的に存在する。タンパク質に対する修飾因子として働き、タンパク質分解、DNA修復、シグナル伝達など多岐にわたって細胞機能を制御する。
(注2)低分子量GTPアーゼ:
一群のGTP結合タンパク質で分子量20-25 kDaのものの総称。GTP を加水分解してGDPに変換し、細胞内シグナル伝達の機能を果たす。
(注3)ホスホリボシル化ユビキチン修飾:
ADPリボシル化活性とホスホジエステラーゼ活性を併せ持つレジオネラ酵素群によって初めて見出されたユビキチン修飾の様式。ユビキチンのアルギニン残基がまずADPリボシル化を受け、ADPリボース部のリン酸ジエステル結合の切断により、AMP が乖離してホスホリボースが付与されたユビキチン(ホスホリボシル化ユビキチン)が産生される。この際、結合基質が存在すれば、その基質がホスホリボシル化ユビキチン修飾を受けることになる。
(注4)トランスグルタミナーゼ:
タンパク質のグルタミン残基側鎖のγ-カルボキシアミド基とリジン残基側鎖のε-アミド基との間のイソペプチド結合による架橋を触媒する酵素。
【問い合わせ先】
<研究に関すること>
東海国立大学機構 岐阜大学 医学部 准教授 久堀智子
電話:058-230-6488 E-mail:kubori.tomoko.j0@f.gifu-u.ac.jp
<報道に関すること>
東海国立大学機構 岐阜大学 総務部広報課広報グループ
電話:058-293-3377 E-mail:kohositu@t.gifu-u.ac.jp
東京薬科大学 総務部広報課
電話:042-676-6711 E-mail:kouhouka@toyaku.ac.jp
▼本件に関する問い合わせ先
総務部 広報課
住所:東京都八王子市堀之内1432-1
TEL:0426766711
FAX:042-676-1633
メール:kouhouka@toyaku.ac.jp
【リリース発信元】 大学プレスセンター https://www.u-presscenter.jp/
プレスリリース情報提供元:Digital PR Platform
スポンサードリンク
「ビジネス全般」のプレスリリース
スポンサードリンク
最新のプレスリリース
- 『第3回GLOBALLERSプロジェクト』奨学生が新郷 礼音さんに決定 2023年9月より渡米し、学業とバスケットボールを両立08/09 18:00
- 総量1kg!インパクト抜群の海鮮丼を家族でシェア!!『でか盛り海鮮問屋』『でか盛り焼肉丼屋』8/10(木)イオンモール札幌苗穂店にオープン!08/09 18:00
- シンガポール大使が「シンガポールと日本の食文化の架け橋になるフェア」と期待!広尾と恵比寿の明治屋ストアーにて「シンガポールフェア」を8月9日(水)から1週間の期間で開催!08/09 18:00
- 株式会社GSIクレオス ホビー部が製品開発の進捗管理にプロジェクト管理ツール「Save Point」を導入し、属人化を解消08/09 18:00
- 【大阪の水中&陸上清掃イベント】「海」×「SDGs」×「ESG」をテーマに掲げた大阪北港マリーナにて、水中&陸上清掃を実施します。08/09 18:00
- 最新のプレスリリースをもっと見る
