関連記事
微生物の接着タンパク質の柔軟かつ強靭な構造を解明―名大・堀克敏氏ら
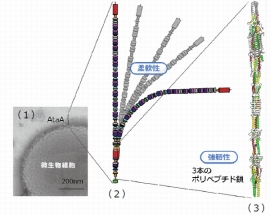
(1)アシネトバクター属最近Tol5の電子顕微鏡写真。細胞表面から出ている細い線がAtaAファイバー、(2)AtaAファイバー(全長)のタンパク質模式、(3)今回解明されたAtaAファイバー(一部)の立体構造(名古屋大学の発表資料より)[写真拡大]
名古屋大学の堀克敏教授らは、独マックスプランク研究所のLupas博士らとの国際共同研究で、微生物のもつ巨大ナノファイバー蛋白質の一部の立体構造を解明することに成功した。この蛋白質は微生物細胞を様々な材料表面に強固に接着させる機能を持っており、今回の成果は、微生物細胞を固定して効率的に利用する技術の改善につながる可能性があるという。
堀教授は今回の巨大ナノファイバー蛋白質を約10年前に発見し、AtaAと名付けていた。その後、薬の原料や化学品を生産する有用な微生物にこの遺伝子を導入してAtaA蛋白質をつくらせることで好きな材料表面に微生物を固定化し、効率的に物質を生産する技術の開発に成功した。一方、AtaAは3630アミノ酸からなる巨大なポリペプチド鎖三本で構成される複雑かつ巨大な蛋白質であり、その立体構造は明らかとなっていなかった。
今回の研究では、AtaA蛋白質の一部の結晶化に成功し、その構造を分析した。その結果、3本のポリペプチド鎖が三つ編み様に編まれてコイルドコイルと呼ばれる超らせん構造などを持ち、簡単には壊すことのできない強い構造体を形成していることがわかった。一方で、曲がることのできる柔軟構造が散りばめられており、剛直ではなく柔軟なファイバーを形成していることもわかった。
さらに、ループと言われる構造があるためファイバーの太さが急激に変化しないことなどが明らかになった。太さの急激な変化は応力集中という現象を引き起こし、そこから壊れやすくなるが、そのような面でも補強されていることがわかった。
また、今回構造が明らかになった部分を削ってもAtaAの接着力は失われなかったが、この部分の構造を少し崩すだけで、ファイバーは細胞上にきちんと立って伸びることができなくなり、細胞接着能力も失われることも明らかになった。これによって、柔軟かつ強靭な構造が、ファイバーが強固な接着能力を発揮するのに重要なことが示された。
今回の成果は、微生物を固定化して効率的に物質を生産する技術の発展につながる可能性がある。また、今回立体構造を解明した部分は、薬剤耐性で世界的に問題になっている病原菌を含むアシネトバクター属細菌の同類蛋白質中に広く保存されており、これらの細菌は、宿主に感染するときにこの類の蛋白質で取り付くことが知られていることから、この付着を防いで感染を防止する技術の開発につながる可能性もあるという。
なお、この内容は「The Journal of Biological Chemistry」に掲載された。
スポンサードリンク
