日本と香港でImpella 5.5 SmartAssistが承認取得; 米国FDAがImpella BTRの患者さん使用への初回アーリーフィージビリティスタディの条件付き治験用医療機器に対する適用免除(IDE)を付与
配信日時: 2022-01-12 18:00:00

日本と香港でImpella 5.5 SmartAssistが承認取得; 米国FDAがImpella BTRの患者さん使用への初回アーリーフィージビリティスタディの条件付き治験用医療機器に対する適用免除(IDE)を付与
(米マサチューセッツ州ダンバース)-(ビジネスワイヤ) -- アビオメッド(NASDAQ: ABMD)が新地域で新製品と新適応による持続的成長戦略の遂行を継続する中、3カ国の規制当局により心臓血管外科医が使用できる新たなImpella製品を承認しました。米国では、食品医薬品局(FDA)がImpella BTR(Bridge-to-Recovery、心機能回復までの橋渡し)に「アーリーフィージビリティスタディ」(EFS)の「治験用医療機器に対する適用免除」(IDE)を付与しました。アジア地域では、Impella 5.5 SmartAssistが日本の医薬品医療機器総合機構(PMDA)と香港の医療機器課(MDD)から承認を受けました。
本プレスリリースではマルチメディアを使用しています。リリースの全文はこちらをご覧ください。:https://www.businesswire.com/news/home/20220110005318/ja/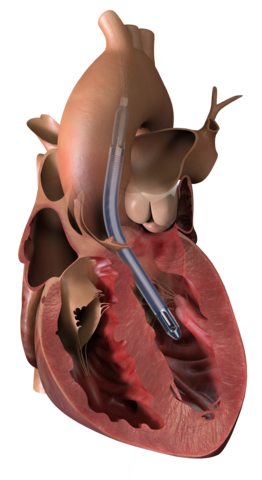 Impella 5.5 SmartAssistの使用が日本と香港で承認(画像:ビジネスワイヤ)
Impella 5.5 SmartAssistの使用が日本と香港で承認(画像:ビジネスワイヤ)
Impella 5.5 SmartAssistは、日本と香港の患者さんにとって今までの治療法を一変させる技術です。心臓外科医が心臓外科医のために設計したImpella 5.5は低侵襲で順行性、完全左心室アンロードが可能な心臓ポンプで、腋窩動脈からの挿入が可能です。2年前にFDAの市販前承認(PMA)を取得しました。現在までに急性心筋梗塞に伴う心原性ショック、心筋症、開心術後の心原性ショックを含む適応で、4000人以上の米国患者さんの治療に使用されています。従来、心原性ショックの生存率は約50%でした。Impella 5.5 SmartAssistで治療された患者さんでは、ポンプ離脱時の生存率は74%で、生存患者の59%が自己心機能の回復を達成しています。
日本においてImpella 5.5 SmartAssistは、心原性ショックなどを原因とする薬物療法抵抗性の急性心不全の治療が適応となりました。日本における最初のImpella 5.5 SmartAssistによる治療は、今後数カ月以内に開始される予定です。
アビオメッドの会長 兼 社長 兼 最高経営責任者(CEO)であるマイケル・R・ミノーグは、次のように述べています。「日本はImpella 5.5 SmartAssistに最適なマーケットです。なぜなら、この技術が低侵襲で長期間のアンローディングを実現できることで、侵襲性の高い胸骨切断や心臓移植が普及していない国において、自己心機能の回復を実現する可能性のある技術だからです。」
また、米国においては、Impella BTRのアーリーフィージビリティスタディにおける条件付き治験用医療機器に対する適用免除(IDE)がFDAから付与され、世界で初めて患者さんがImpella BTRによる治療を受ける道が開かれました。Impella BTRは、1分間に6リットル以上の血流を供給できる経皮的心臓ポンプです。現在のLVADよりもはるかに低侵襲に設計されています。
Impella BTR開発プログラムの構想は、患者さんが退院して自宅に戻ることができ、最長1年間にわたり完全な循環補助が可能になることです。アーリーフィージビリティスタディでは、最大5か所の病院で10人の患者さんが登録され、最長28日間にわたりImpella BTRでサポートされる予定です。最初のImpella BTRの患者さんは、今年の3月または4月に治療が開始される見込みです。
マイケル・R・ミノーグは、次のように述べています。「FDAの承認は、慢性心不全の患者さんにとって、より長期型・低侵襲の順行性スマート心臓ポンプの実現に向けた第一歩です」
Impella BTRは治験用デバイスであり、米国連邦法により用途は治験での使用に限定されています。
IMPELLA心臓ポンプについて
Impella 2.5®およびImpella CP®の各デバイスは、閉塞した冠動脈を再開通するためにステント留置術やバルーン血管形成術などの待機的または緊急の経皮的冠動脈形成術(PCI)を受ける特定の進行性心不全患者の治療を目的として、米国FDAの承認を取得しています。
Impella 2.5、Impella CP、Impella CP SmartAssist®、Impella 5.0®、Impella LD®、Impella 5.5® SmartAssist®は、心原性ショック状態にある心臓発作または心筋症患者の治療を目的に米国FDAの承認を取得しており、心臓の自然な回復を可能にする独自の機能を有しているため患者さんが自分の心機能を回復させ帰宅することができます。
Impella BTR®は治験用デバイスであり、連邦法により用途は治験での使用に限定されています。
アビオメッドについて
米マサチューセッツ州ダンバースに拠点を置くアビオメッドは、循環補助デバイスと酸素化デバイスのリーディングカンパニーです。当社製品は血行動態を改善し、呼吸不全の患者さんに十分な酸素を供給することで心筋の負担を軽減し、その回復を目指しています。詳細情報については www.abiomed.comをご覧ください。
将来見通しに関する記述
将来見通しに関する記述はいずれも、アビオメッドが米国証券取引委員会に提出した定期報告書で記載されたものなど、リスクと不確実性の影響を受けます。実際の結果は予想された結果とは大きく異なる可能性があります。
本プレスリリースは、米国アビオメッド・インクが現地時間2022年1月10日に発表した英文プレスリリースを日本語訳したものです。正式な言語は英語であり、日本に適応しない内容が含まれます。解釈は英語が優先されます。
本記者発表文の公式バージョンはオリジナル言語版です。翻訳言語版は、読者の便宜を図る目的で提供されたものであり、法的効力を持ちません。翻訳言語版を資料としてご利用になる際には、法的効力を有する唯一のバージョンであるオリジナル言語版と照らし合わせて頂くようお願い致します。
businesswire.comでソースバージョンを見る:https://www.businesswire.com/news/home/20220110005318/ja/
連絡先
For further information please contact:Media Contact:
Tom Langford
Director of Communications
+1 (978) 882-8408
tlangford@abiomed.comInvestor Contact:
Todd Trapp
Vice President and Chief Financial Officer
+1 (978) 646-1680
ttrapp@abiomed.com
プレスリリース情報提供元:ビジネスワイヤ
スポンサードリンク
「Abiomed, Inc.」のプレスリリース
スポンサードリンク
最新のプレスリリース
- 24/7面接プラットフォーム『Interview Cloud(インタビュークラウド)』、AIを活用した次世代型ハイブリッド面接サービスとして今秋提供開始!11/16 21:40
- 【自治体連携 デジタルノマド観光施策】観光振興および地域の経済発展を図る「那智勝浦町 × シェアウィング包括連携協定」を締結11/16 20:40
- 【児童虐待防止協会 西澤 哲 先生 特別セミナーのご案内】どのように子どもの意見・思いを聴いていくか11/16 18:45
- ファミケア、疾患・障がい児家族とサービス・商品を繋げる企業向けサービス「ブランドソリューション」を提供開始11/16 18:45
- レッスン曜日を拡大。新規生徒募集中!ただいま入会金無料キャンペーン!企業を取材し、社会と繋がる。新しい学びの場!動画制作スクール「アンイーブンプラス」11/16 18:45
- 最新のプレスリリースをもっと見る

