第一三共、研究開発費の増加、「エンハーツ」に係る費用増等により3Qの営業利益は前年比-42.5%
2021年2月6日 15:31
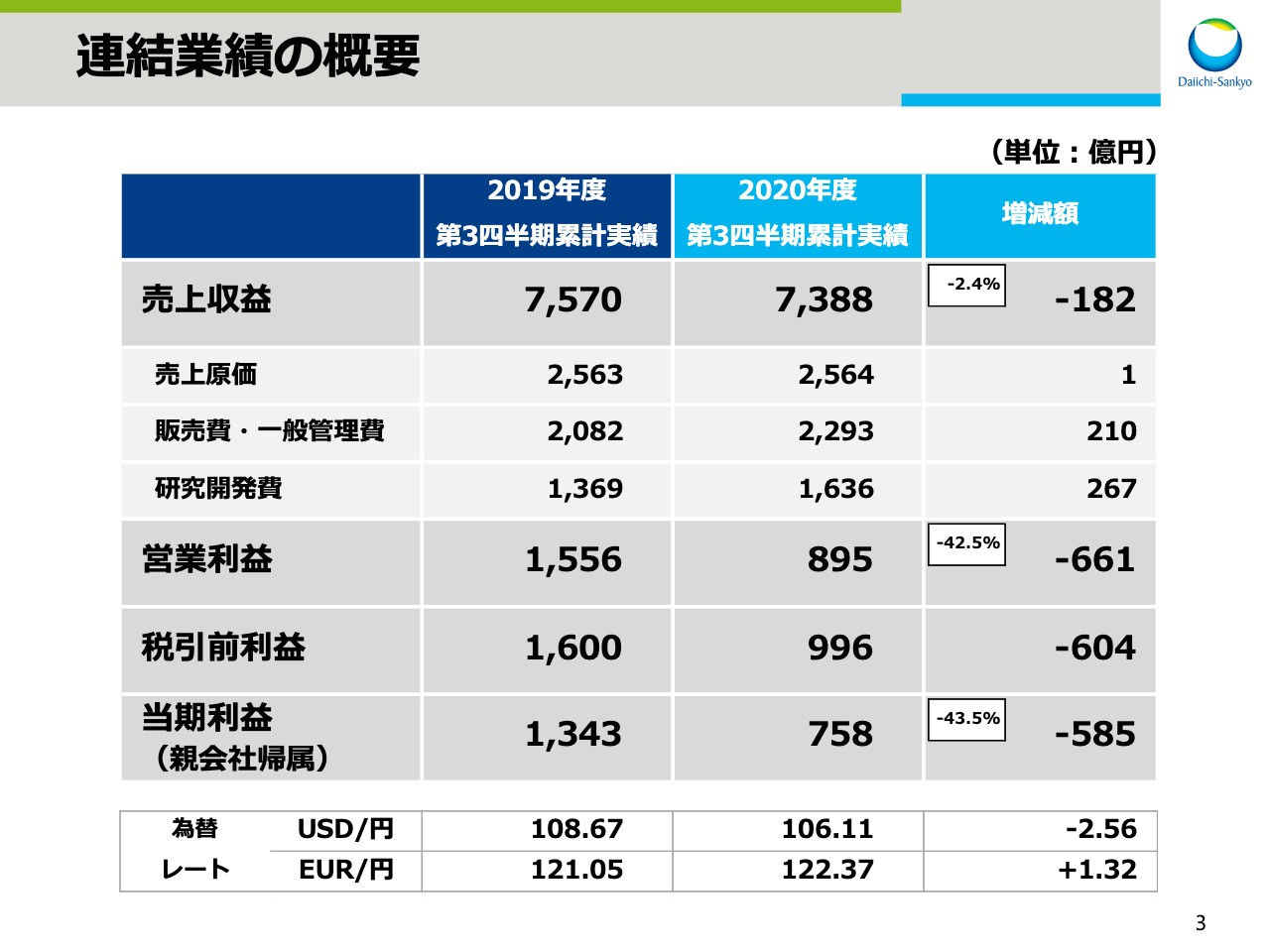
連結業績の概要
齋寿明氏:齋でございます。本日はご多忙のところ、第一三共の決算カンファレンスコールにご参加いただきありがとうございます。それでは、本日13時30分に発表いたしました2020年度第3四半期決算につきまして、資料に基づき説明させていただきます。
スライド2をご覧ください。本日お話しする内容でございますが、2020年度第3四半期連結決算、ビジネスアップデートの順番でお話しします。その後、研究開発本部長の高崎から研究開発アップデートについてお話しします。みなさまからのご質問は最後にお受けします。
スライド3をご覧ください。こちらのスライドは、2020年度第3四半期決算の概要をお示ししています。連結売上収益は7,388億円、前年同期比182億円、2.4パーセントの減収となりました。売上原価は前年同期比1億円増、販売費・一般管理費は210億円増、研究開発費は267億円増となりました。
この結果、営業利益は895億円、前年同期比661億円、42.5パーセントの減益。税引前利益は、前年同期比604億円減益の996億円。そして、親会社帰属の当期利益は758億円、前年同期比585億円、43.5パーセントの減益となりました。
為替レートの実績でございますが、1ドルは106円11銭となり、前期よりも2円56銭の円高、1ユーロは122円37銭となり、前期よりも1円32銭の円安となりました。
売上収益増減

スライド4をご覧ください。ここからは前年同期比での増減要因について説明いたします。売上収益は前年同期比182億円の減収となりましたが、その内訳を主要事業ユニット別に説明いたします。
まず国内医薬、ワクチン、ヘルスケアを含む日本事業では、一昨年4月に発売した疼痛治療剤「タリージェ」の売上が拡大したことに加え、昨年の9月に発売した「メマンチンAG」と「エゼチミブAG」等の寄与により、第一三共エスファ製品の売上は増加したものの、アルツハイマー型認知症治療剤「メマリー」、抗インフルエンザウイルス剤「イナビル」、直接経口抗凝固剤「リクシアナ」、およびワクチン事業の減収に加え、第一三共ヘルスケア製品の売上が減少したため、日本事業全体では396億円の減収となりました。
次に、海外事業について説明いたします。ここでは為替変動の影響を除外したかたちで記載しております。米国の第一三共Inc.は、高コレステロール血症治療剤、2型糖尿病治療剤「ウェルコール」の売上が減少したものの、昨年1月に上市した抗悪性腫瘍剤「エンハーツ」の寄与により、124億円の増収となりました。
一方、アメリカン・リージェントは、COVID-19の影響等により、鉄欠乏性貧血治療剤の「インジェクタファー」の売上が減少したことから、65億円の減収となりました。
第一三共ヨーロッパは、「リクシアナ」の売上拡大に加え、昨年6月に長期収載品の譲渡益を計上したことにより、143億円の増収となりました。
なお「エンハーツ」および「DS-1062」、一般名「ダトポタマブ デルクステカン」「Dato-DXd」の戦略的提携に係る契約時一時金と開発マイルストンの当期売上収益認識分は、「ダトポタマブ デルクステカン」の契約一時金の繰延収益を計上したことから、25億円の増収となりました。なお、為替による減収影響は全体で59億円でした。
営業利益増減
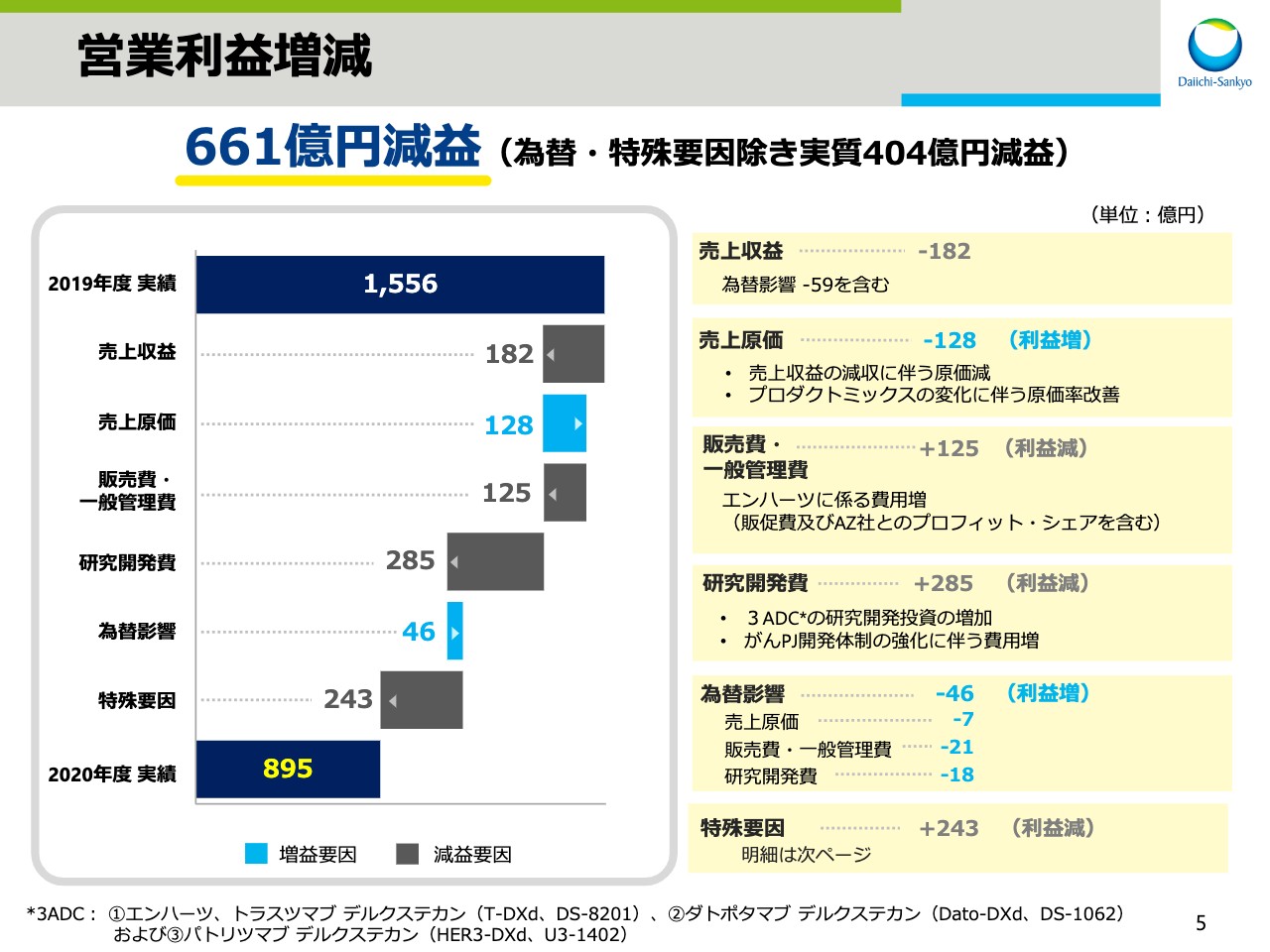
スライド5では、営業利益の増減要因をお示ししております。前年同期比661億円の減益となりましたが、その要因を項目別に説明させていただきます。先ほどの説明のとおり、売上収益は為替影響による減収59億円を含めて、182億円の減収となりました。
次に、売上原価と経費について、為替影響・特殊要因を除いて説明いたします。売上原価は、売上収益の減収に伴う原価減に加え、プロダクトミックスの変化に伴う原価率の改善により、128億円減となりました。販売費・一般管理費は、COVID-19の拡大に伴う経費の減少影響があったものの、「エンハーツ」に係る費用増により125億円増となりました。
研究開発費は、3ADCの研究開発投資の増加、およびがんプロジェクトの開発体制強化に伴う費用増により、285億円増となりました。為替影響による費用減は合計で46億円でした。特殊要因では、前期と比較すると243億円の費用の増加影響がありました。特殊要因の影響の内訳は後ほどご説明いたします。なお、為替と特殊要因による影響を除外すると、実質で404億円の減益でした。
特殊要因の内訳
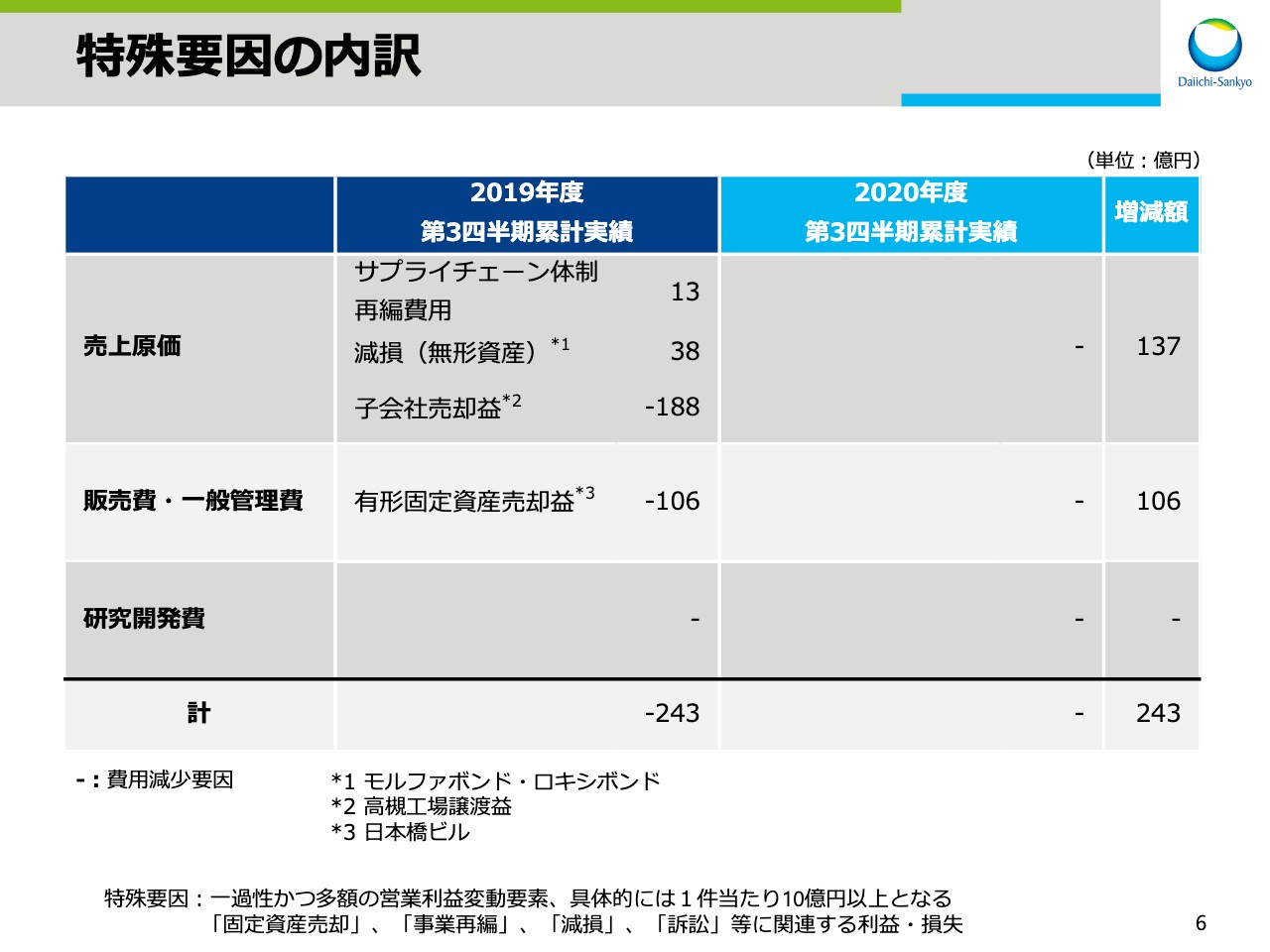
スライド6をご覧ください。こちらは特殊要因の内訳をお示ししております。前期はサプライチェーン体制の再編費用13億円と、無形資産の減損38億円を計上した一方で、子会社売却益188億円と有形固定資産売却益106億円を計上したことにより、合計で243億円の費用の減少影響がありました。今期は特殊要因がなかったため、前期に比べますと243億円の費用の増加影響がありました。
当期利益(親会社帰属)増減
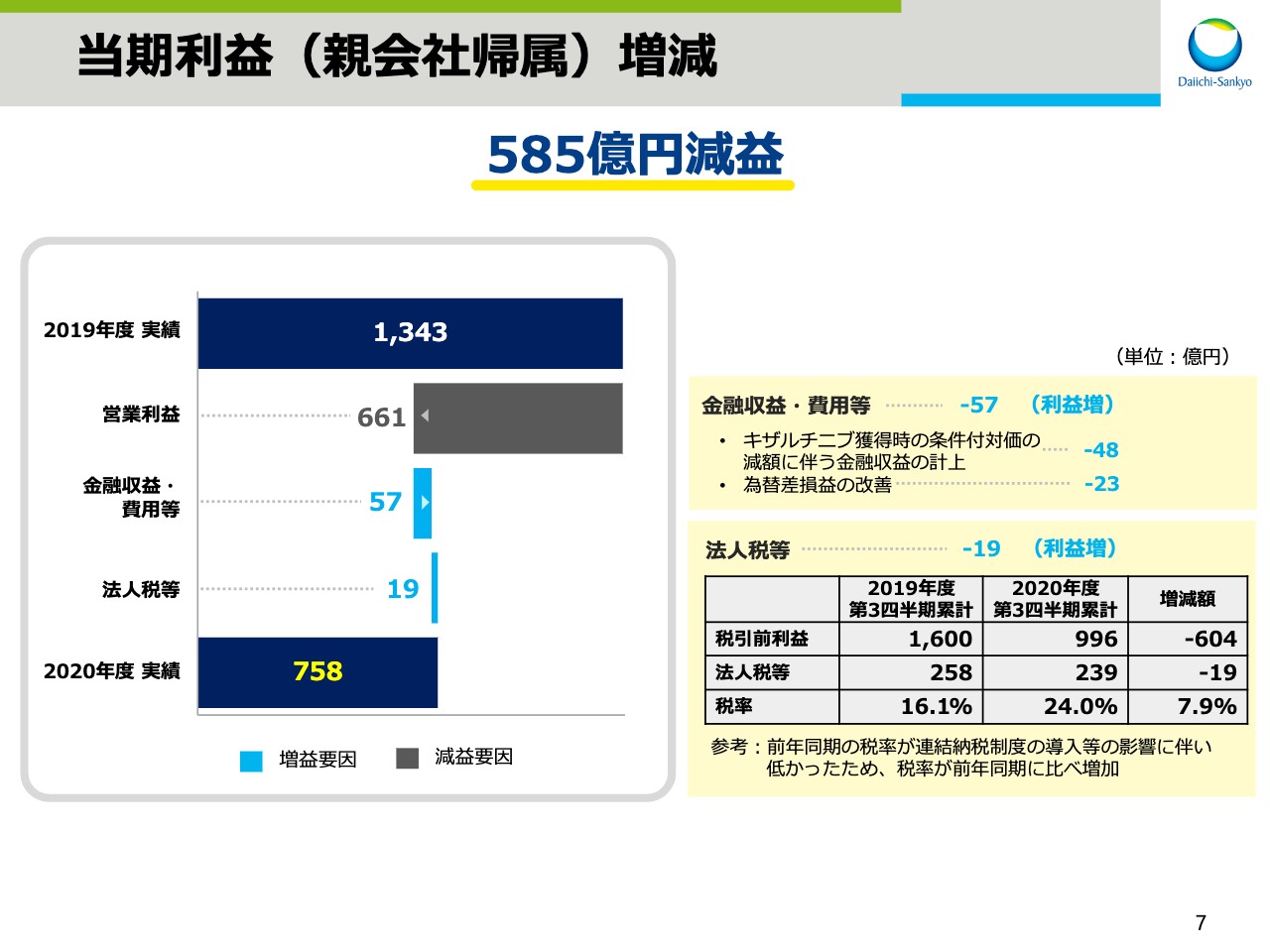
次に、スライド7で当期利益の増減についてご説明いたします。営業利益は、先ほどの説明のとおり、為替と特殊要因による影響を含め661億円の減益となりました。金融収益・費用は、「キザルチニブ」獲得時の条件付対価の減額に伴う金融収益を48億円計上したことなどによりまして、前年同期に比べ57億円の増益影響がありました。
法人税は、税引前利益が大幅に減少したものの、前年同期の税率が連結納税制度の導入等の影響に伴い、当期よりも低かったため、法人税額は19億円の減にとどまりました。その結果、親会社帰属の当期利益は758億円、対前年同期比585億円の減益となりました。
主要ビジネスユニット 売上収益増減(為替影響を含む)
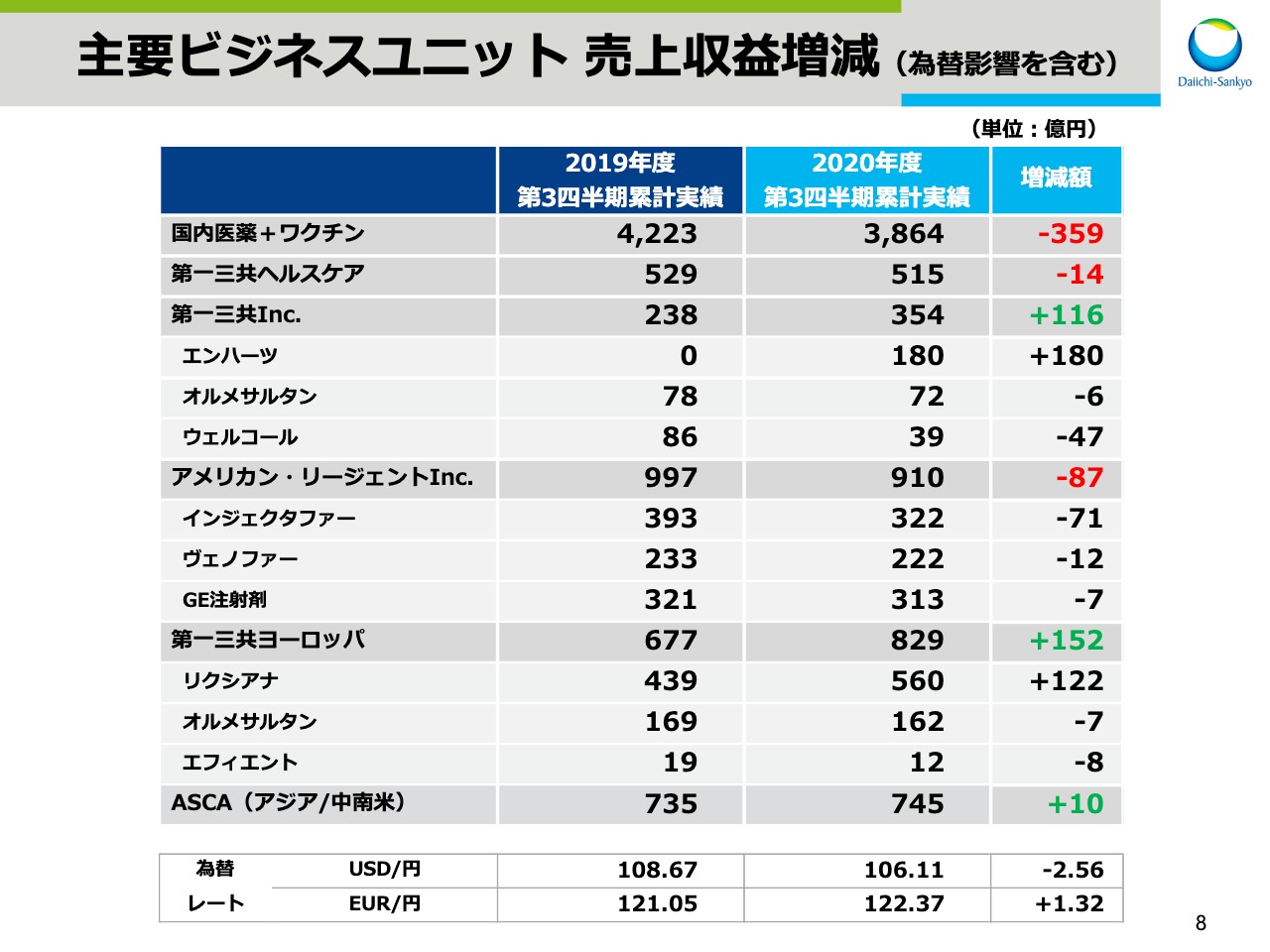
スライド8、9は、主要ビジネスユニット、国内主要製品の円ベースでの売上増減でございます。先ほどのスライド4では、為替影響を除いた各ユニットの状況をご説明しましたが、こここでは為替影響を含んだ実績をお示ししております。なお、2020年度の連結業績予想は、10月公表時から修正はありません。また、COVID-19の拡大による業績影響につきましても、10月にお示した影響と同程度と見込んでおります。
エンハーツ®:製品価値最大化の取り組み

次に、ビジネスアップデートについてお話します。スライド11をご覧ください。スライド11では、「エンハーツ」の製品価値最大化の取り組みについてお話しします。米国と日本を合わせた「エンハーツ」の2020年度第3四半期累計の製品売上は207億円でした。昨年1月の米国での上市以来、順調に販売国と適応が拡大しています。
乳がんについては、米国、日本に続きEUにおいても、HER2陽性乳がんの3次治療の適応で今年1月に薬事承認を取得しました。EUでの承認は、迅速審査のもと、昨年の申請受理後、7ヶ月で承認を取得できました。なお、「エンハーツ」はEUにおいてシングルアームのフェーズ2試験の結果に基づき、乳がんの適応で承認された、過去20年間で最初の製品となりました。
さらに胃がんについては、日本に続き米国で適応を取得しました。米国では優先審査のもと、昨年10月の申請受理後、3ヶ月で承認されました。
本件は、アジア人のみを対象とした臨床試験の結果に基づき、米国で承認された極めて稀なケースで、さらにHER2陽性胃がんの3次治療の臨床試験結果に基づき、2次治療の適応を取得するという極めてポジティブな結果が得られたことから、「エンハーツ」の製品プロファイルになお一層の自信を深めております。
今後、「エンハーツ」をより多くのがん患者さんにお届けして、製品価値の最大化を図ってまいります。
エンハーツ®:売上収益
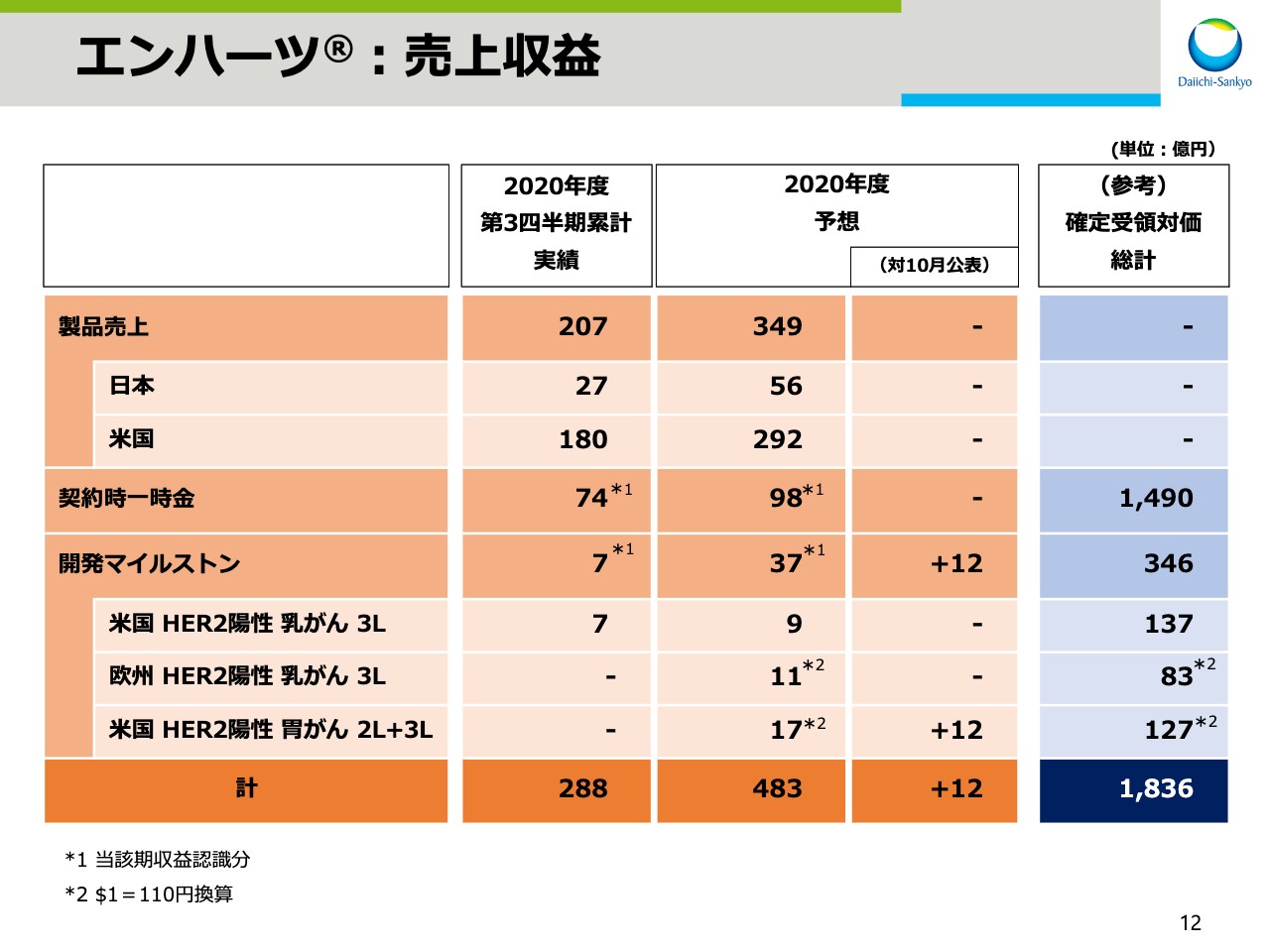
スライド12では、「エンハーツ」の売上収益の内訳をお示ししています。2020年度、第3四半期の累計実績において、製品売上207億円に契約時一時金と開発マイルストンを加えたエンハーツの売上収益は、合計で288億円となりました。
2020年度の業績予想は、合計で483億円を見込んでいます。そのうち開発マイルストンの売上収益は37億円です。10月に公表した業績予想では、米国のHER2陽性胃がんの3次治療の適応取得を前提としていましたが、2次治療の適応も合わせて取得したことから、2020年度の開発マイルストンの売上収益の計上見込み額は、10月公表値と比べ12億円増加いたしました。
各地域の事業成長に向けた取り組み
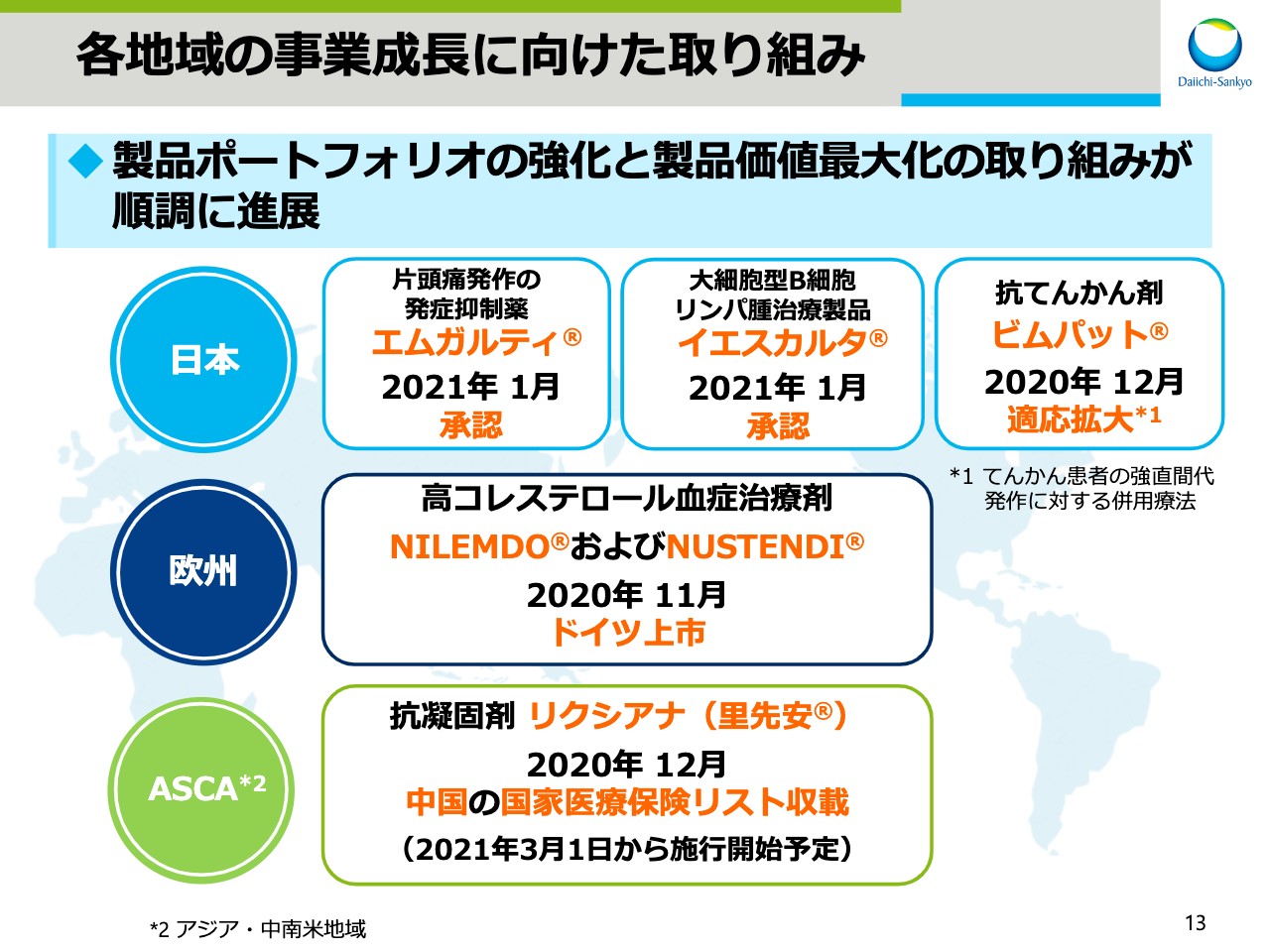
スライド13では、各地域の事業成長に向けた取り組みをお示ししています。各地域の製品ポートフォリオの強化と、製品価値最大化の取り組みも順調に進展しています。
日本では、イーライリリーと販売提携契約を締結した国内ファーストインクラスの片頭痛発作発症抑制薬「エムガルティ」と、米国Kiteから導入したCAR-T細胞療法の大細胞型B細胞リンパ種治療製品「イエスカルタ」について先週承認を取得しました。さらに、昨年12月には、国内主力製品の一つである抗てんかん剤「ビムパット」の適応が拡大され、強直間代発作に対する併用療法の効能効果が追加されました。
欧州では、「NILEMDO」と「NUSTENDI」を昨年11月にドイツで上市しました。さらに、アジア、中南米地域のASCAでは、昨年8月に中国で上市した抗凝固剤「リクシアナ」が12月に国家医療保険リストに収載されました。
欧州:新製品の上市

スライド14で、ドイツで上市した「NILEMDO」と「NUSTENDI」について紹介いたします。Esperionから導入した高コレステロール血症治療剤「NILEMDO」はベムペド酸の単剤で、ファーストインクラスの経口ACL阻害剤です。
一方、「NUSTENDI」は、ベムペド酸とエゼチミブの配合剤で、いずれもスタチンをはじめとする既存薬と組み合わせることでコレステロールを低下させる、新たな治療法を提供する薬剤です。抗凝固剤「リクシアナ」とのシナジー効果により、欧州でのリージョナルバリューを向上させてまいります。
ここからは研究開発アップデートです。研究開発本部長の高崎にバトンタッチします。
3ADC アップデート

高崎渉氏:高崎でございます。本日は私より、研究開発のアップデートについてお話しさせていただきます。スライド16は本日の内容です。3ADCについては、ご覧のようにすべて一般名がつきましたが、本発表では「DS-8201」は「エンハーツ」または「T-DXd」、「DS-1062」は「Dato-DXd」、「U3‐1402」は「HER3‐DXd」と略させていただきます。
また、今回は世界肺がん学会での発表と結果発表が同日であったことから、学会発表内容をご覧いただけていないことを想定し、発表スライドの大部分を本資料に掲載いたしました。ご不明な点は後ほどのQ&Aセッションを活用いたしたく、それらスライドの詳細な説明は割愛させていただきますことをご了承ください。
エンハーツ®:DESTINY-Lung01試験デザイン

スライド17からは、本日肺がん学会で発表しました「エンハーツ」のDESTINY-Lung01試験のHER2陽性コホートの中間データを紹介いたします。このスライド17は試験デザインです。
DESTINY-Lung01(HER2陽性):患者背景
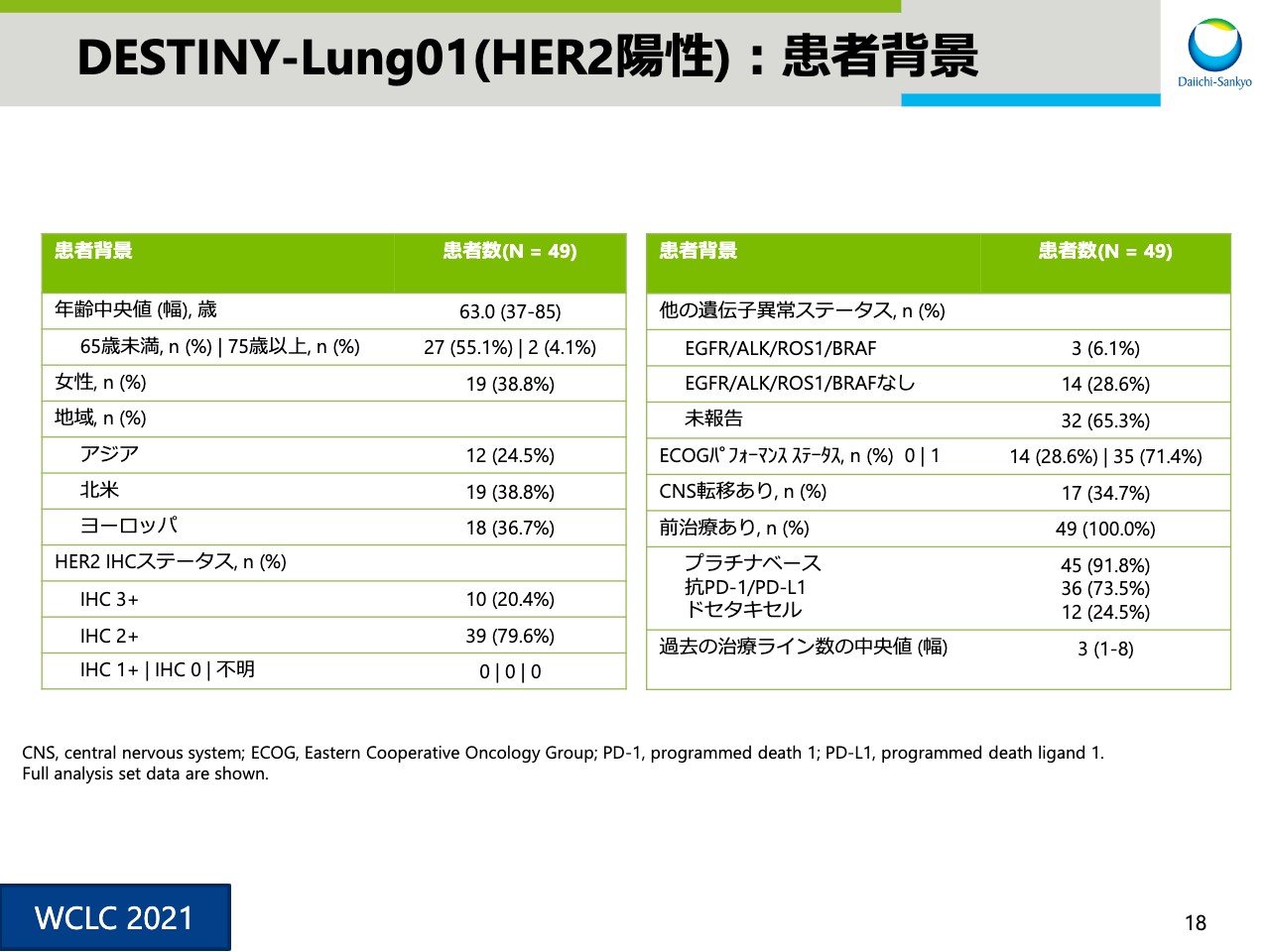
スライド18は患者背景です。
DESTINY-Lung01(HER2陽性) :有効性①
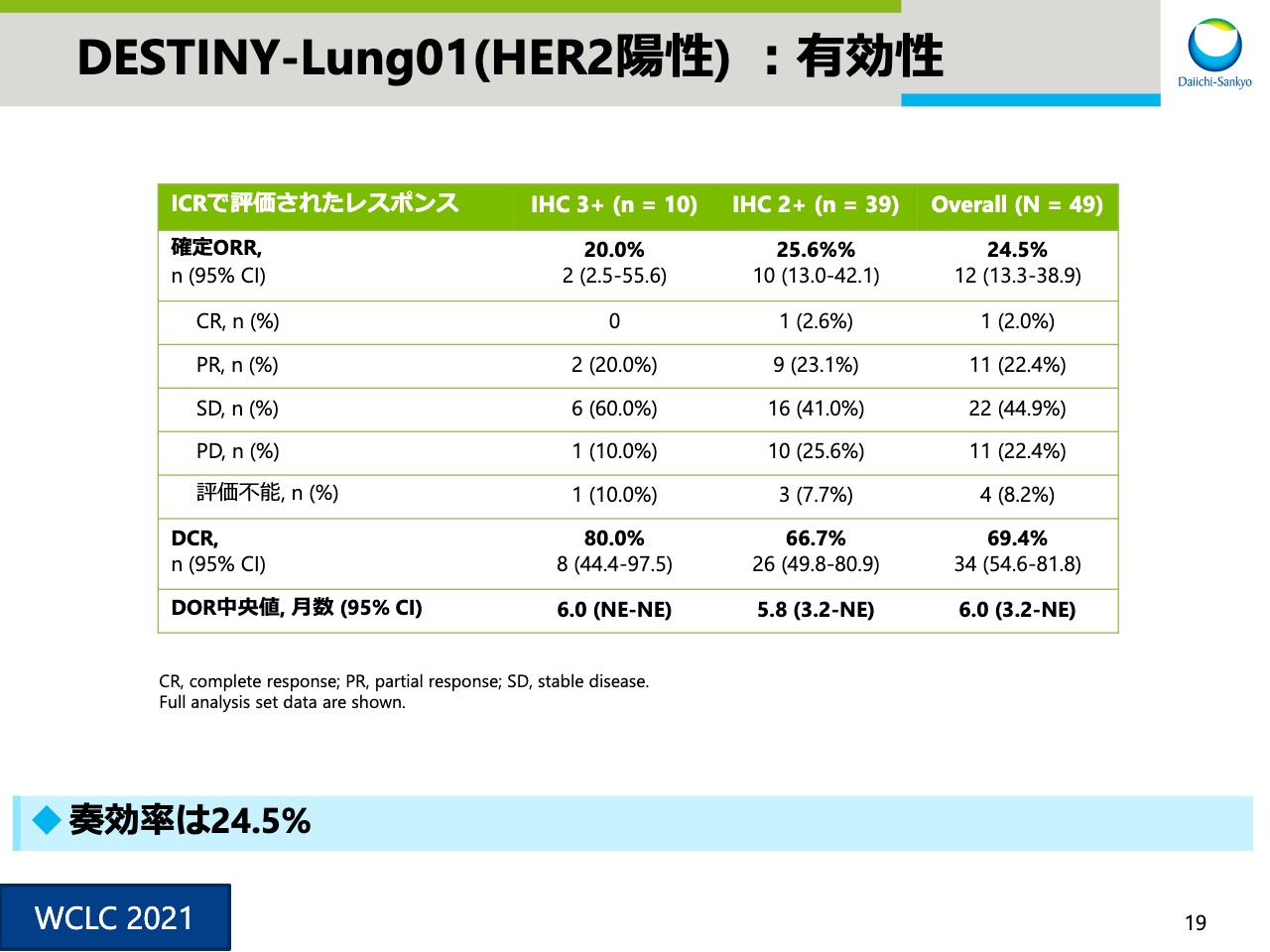
スライド19は有効性結果の一覧です。全体の奏効率は24.5パーセントでした。
DESTINY-Lung01(HER2陽性) :有効性②
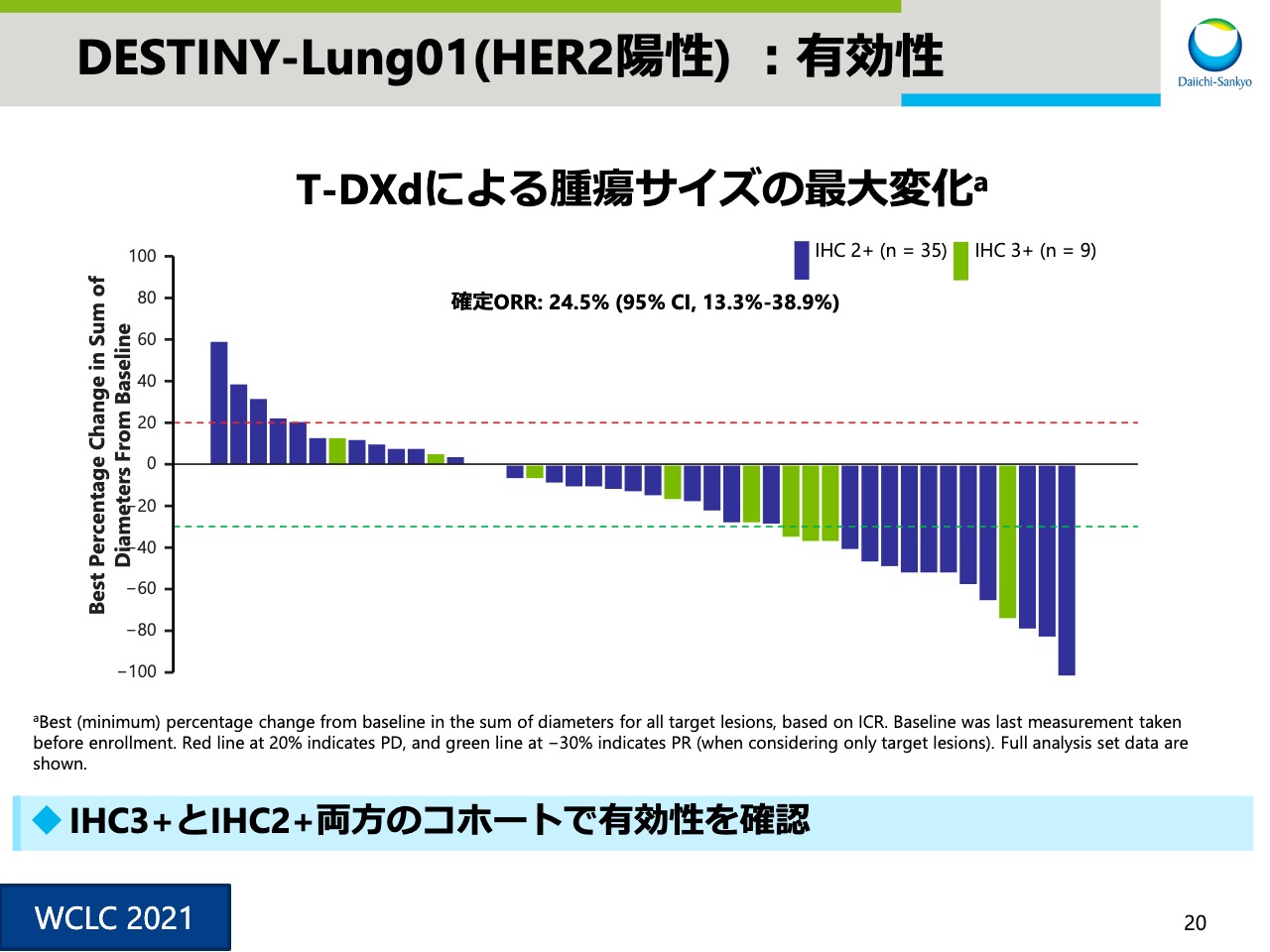
スライド20は、腫瘍サイズの最大変化を示したウォーターフォールプロットです。IHC3+、IHC2+の両方で有効性を確認しました。
DESTINY-Lung01(HER2陽性) :有効性③
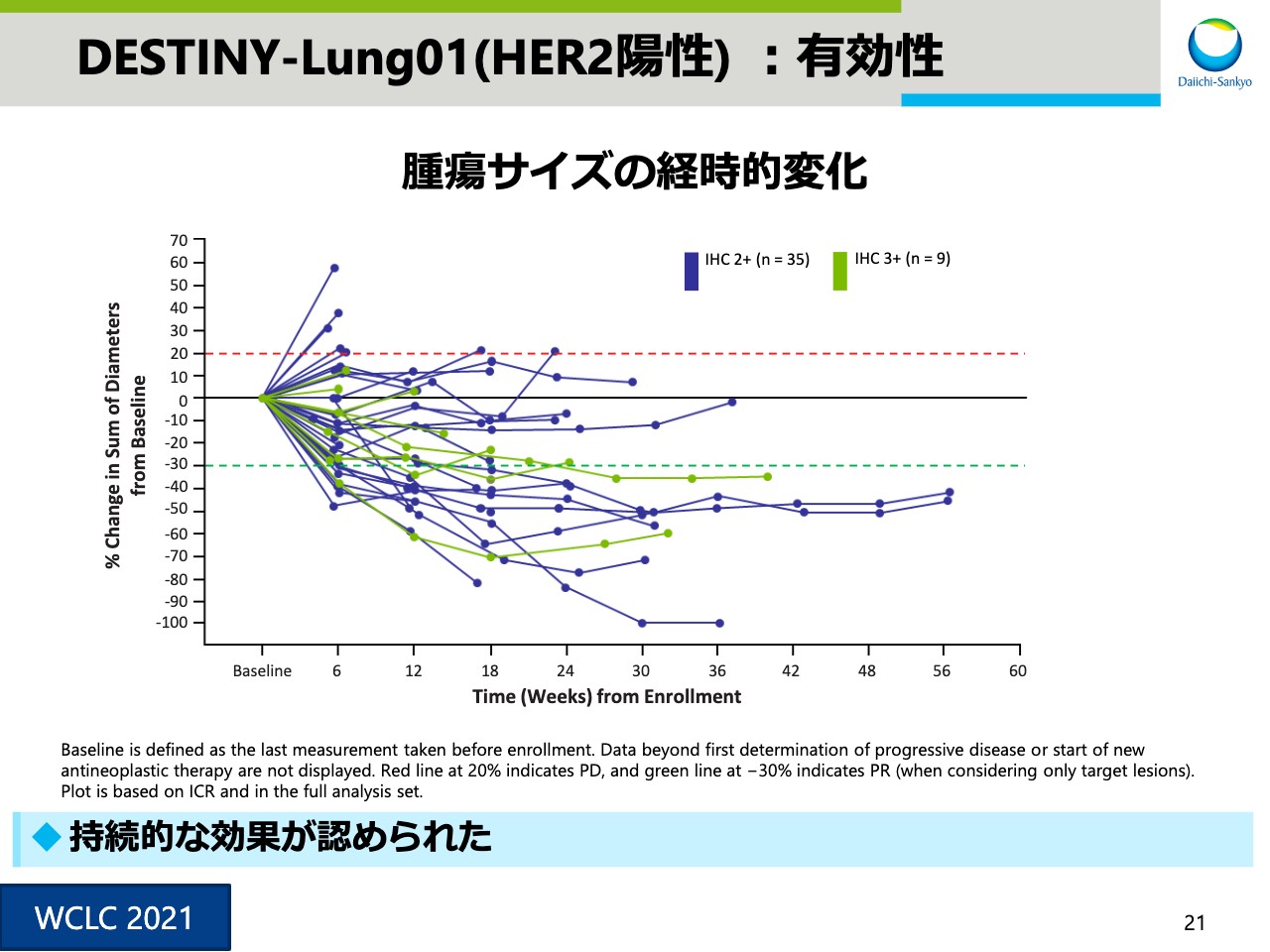
スライド21は、腫瘍サイズの経時的変化を示したスパイダープロットです。持続的な効果が認められました。
DESTINY-Lung01(HER2陽性) :有効性④
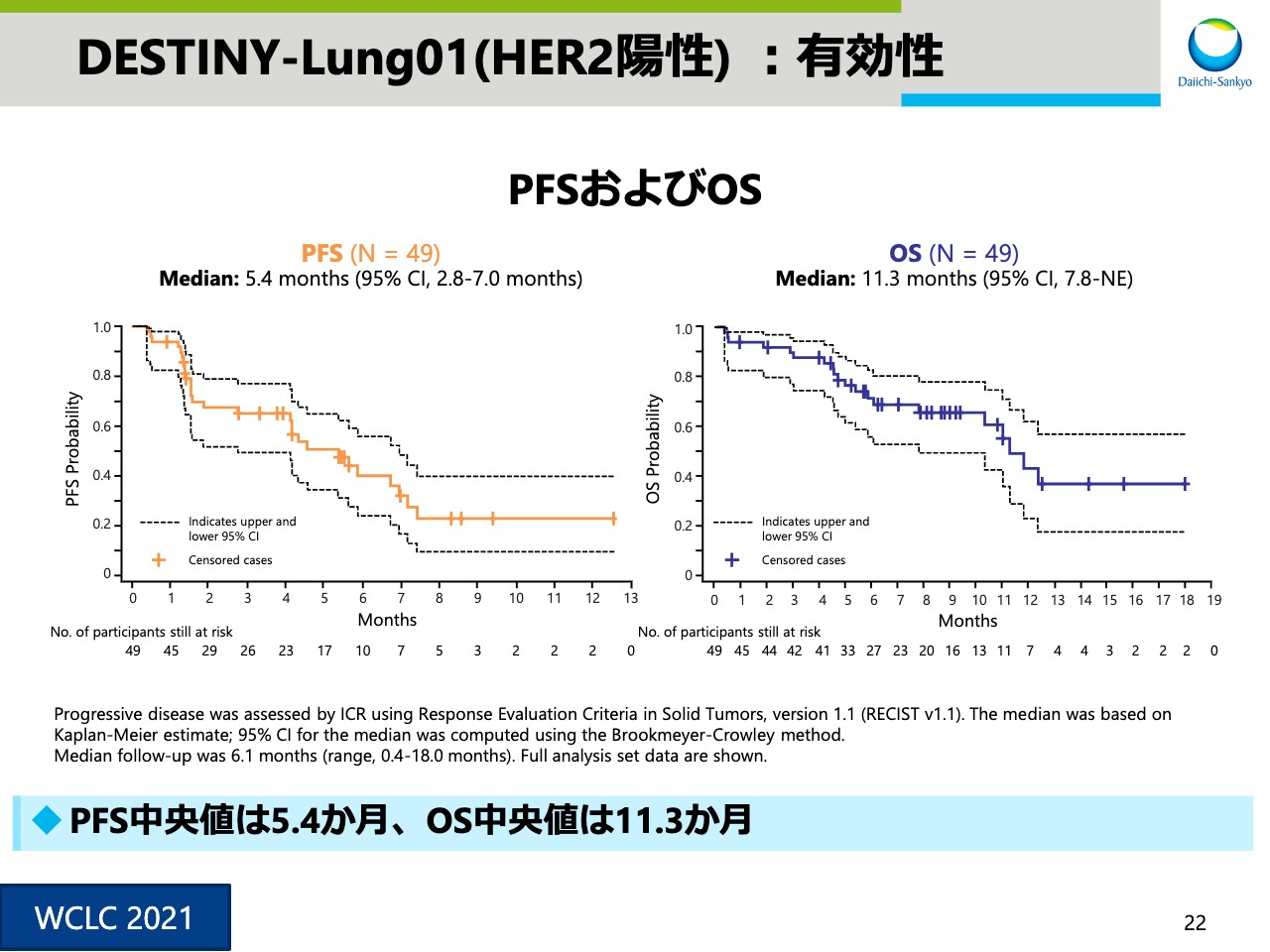
スライド22は、PFSとOSのデータです。フォローアップ期間中央値は6.1ヶ月、PFS中央値は5.4ヶ月、OS中央値は11.3ヶ月でした。
DESTINY-Lung01(HER2陽性) :安全性①
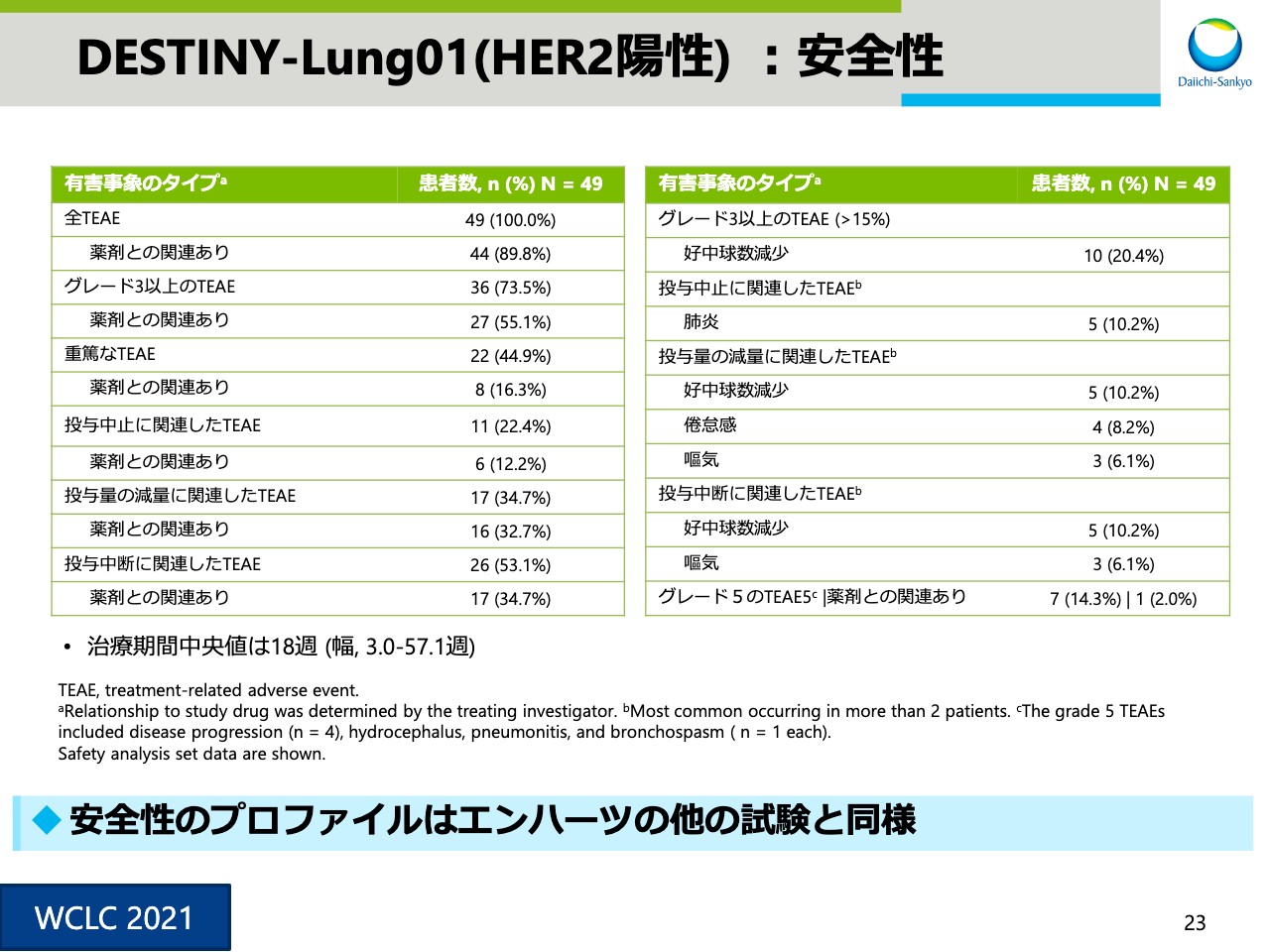
スライド23は安全性の概要です。安全性プロファイルは他の試験結果とおおむね同様でした。
DESTINY-Lung01(HER2陽性) :安全性②

スライド24は、ILDに関する情報です。ILDの発現率は他の試験に比べやや高めですが、これは注意深いモニタリングでの早期発見によるものと考察しています。また3例の死亡例に関しては、肺に関連した既往症があることがわかっています。ILDの発現要因については、現時点では不明、判明しておりませんけども、引き続き注意深くモニタリングを行っていきます。
DESTINY-Lung01(HER2陽性) :サマリー

スライド25は、DESTINY-Lung01試験のサマリーです。今回認められた有効性と安全性の結果は、HER2陽性非小細胞肺がんの今後の開発を支持する結果と考えております。本試験の最終解析結果は2021年度上期に得られる予定で、今後の開発計画については追って発表させていただきます。
Dato-DXd:TROPION-PanTumor01試験デザイン
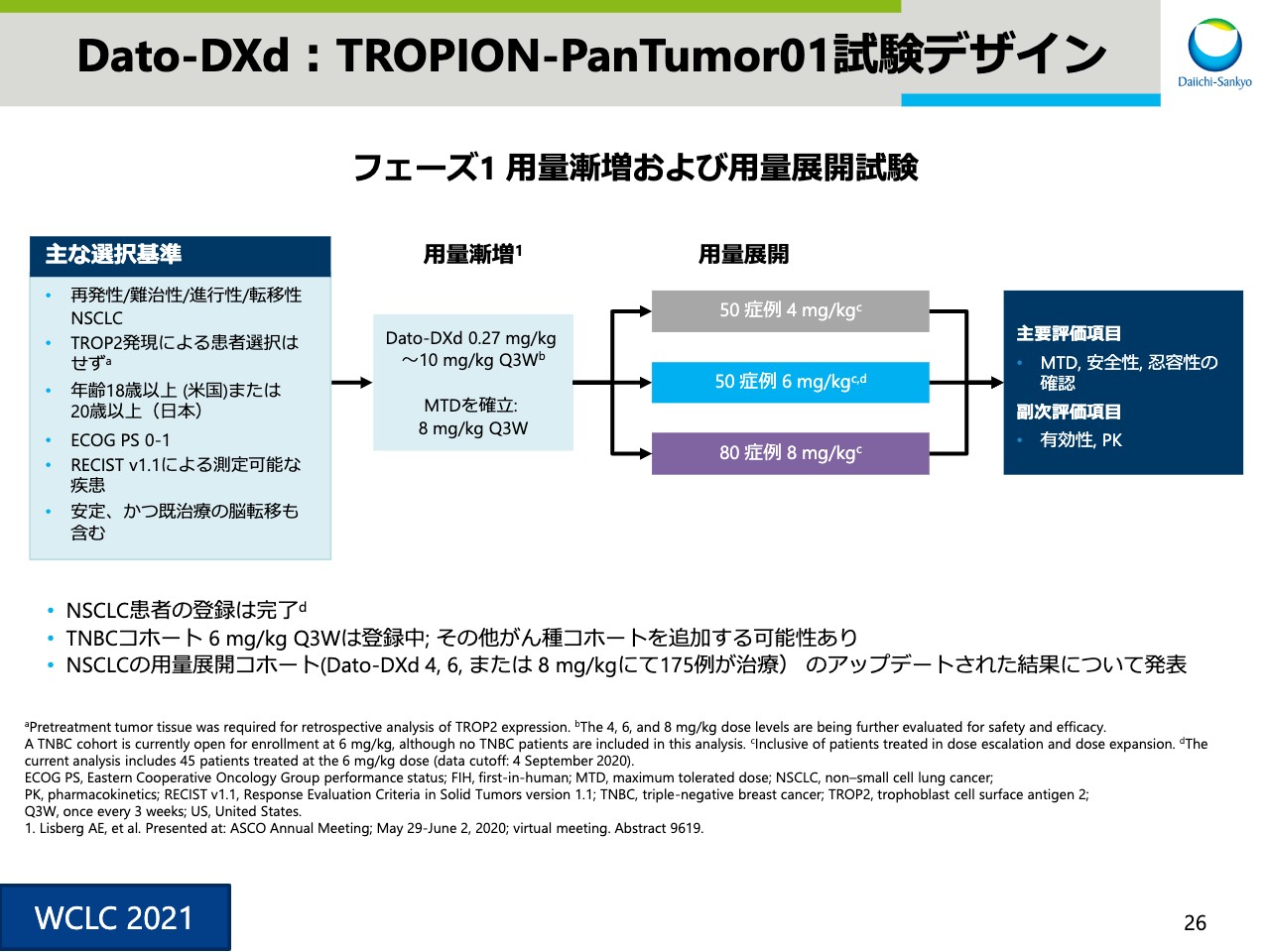
スライド26からは、本日、世界肺がん学会で発表しました「DS-1062」「Dato-DXd」のフェーズ1試験、肺がんコホートの中間データを紹介させていただきます。スライド26は試験デザインです。
TROPION-PanTumor01:患者背景
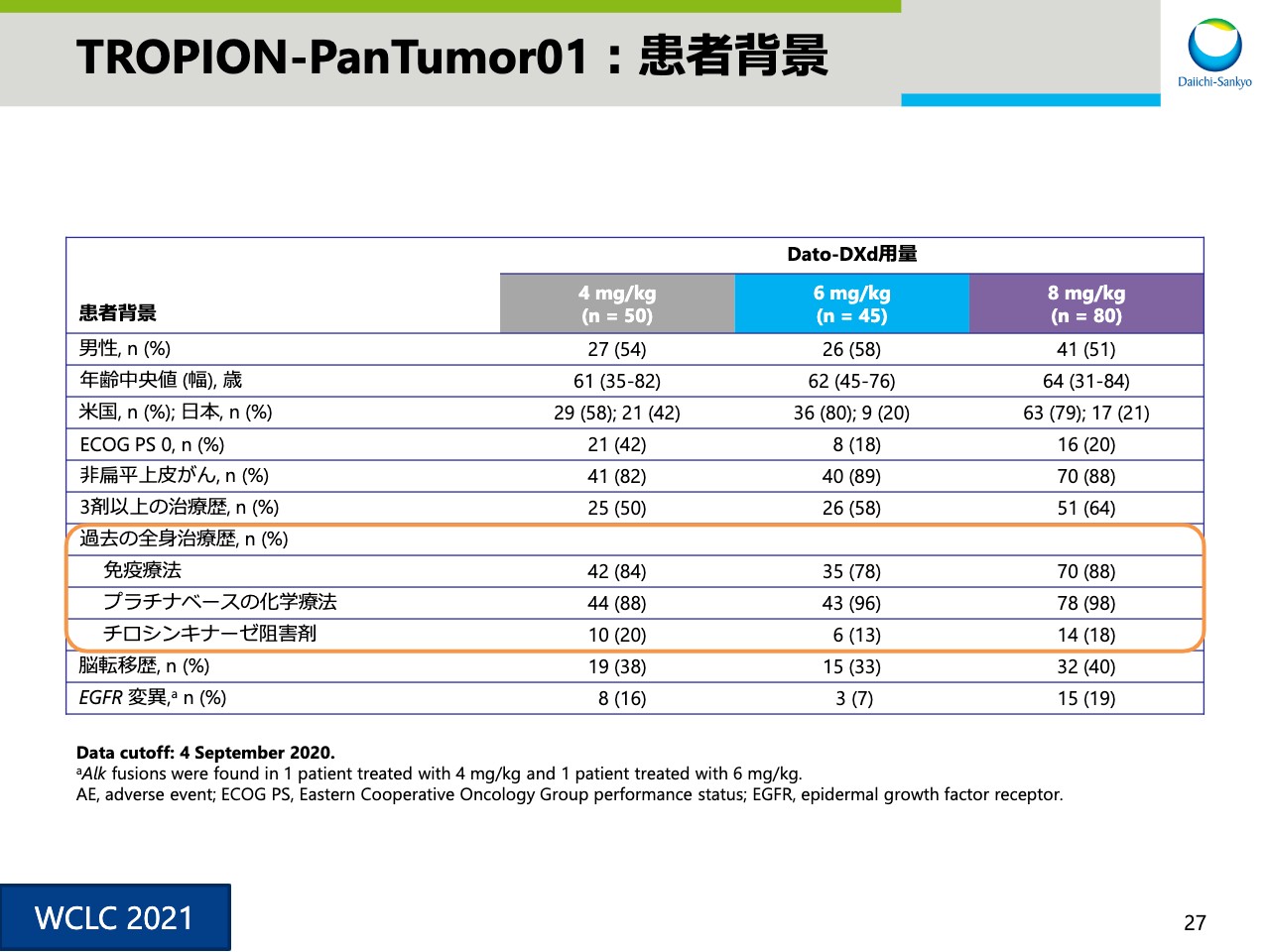
スライド27は患者背景です。患者の約8割は免疫療法による治療歴があります。
TROPION-PanTumor01:治療の状況
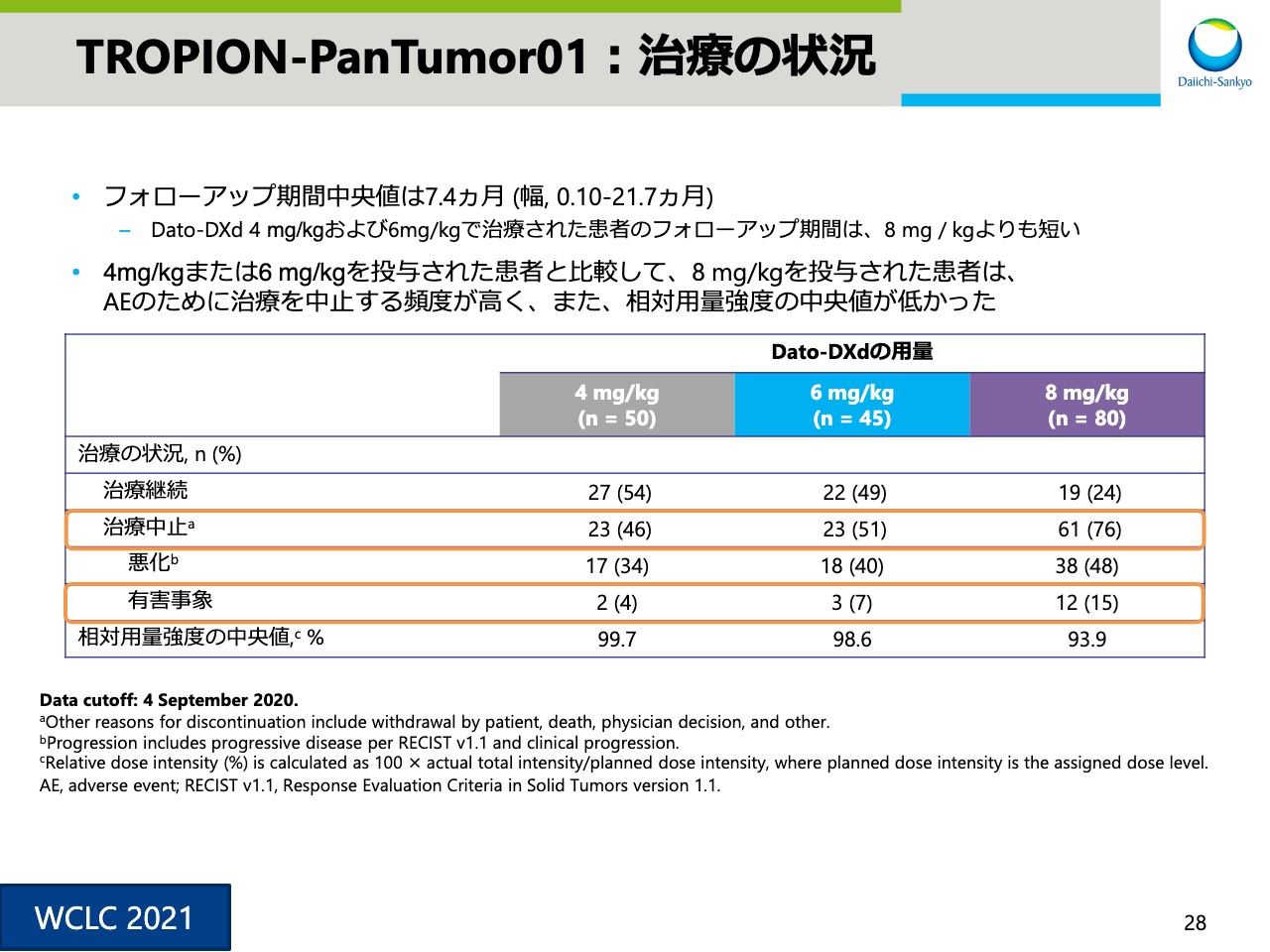
スライド28は治療の状況です。4mg/㎏または6mg/kgを投与された患者に比べ、8mg/kgを投与された患者では高頻度で有害事象が見られたため、治療の中止につながっています。
TROPION-PanTumor01:安全性①
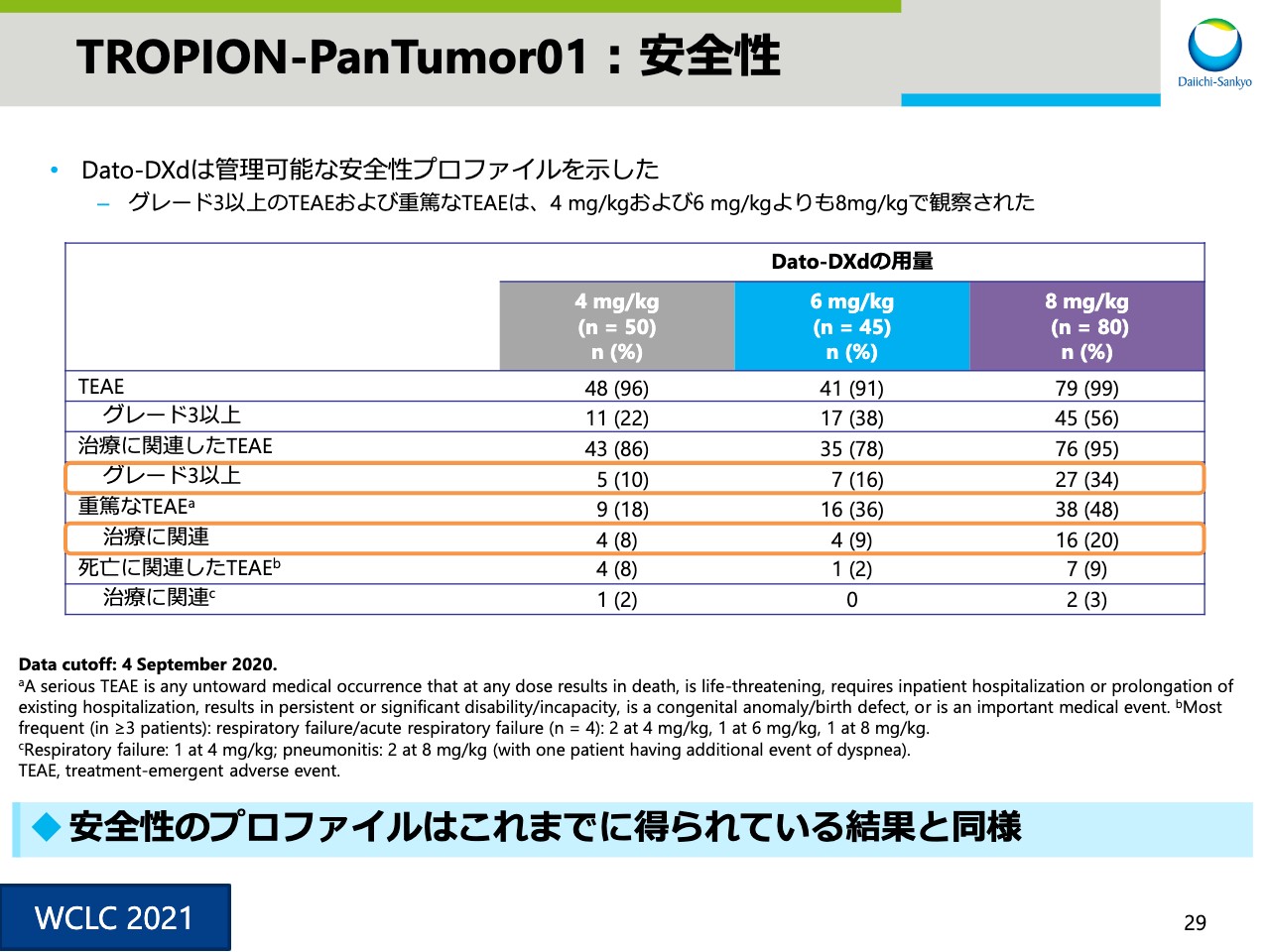
スライド29は安全性の概要です。TEAEおよび重篤なTEAEなどの頻度、それから容量との関係性などの安全性のプロファイルは、これまでに確認している内容と同様でした。
TROPION-PanTumor01:安全性②
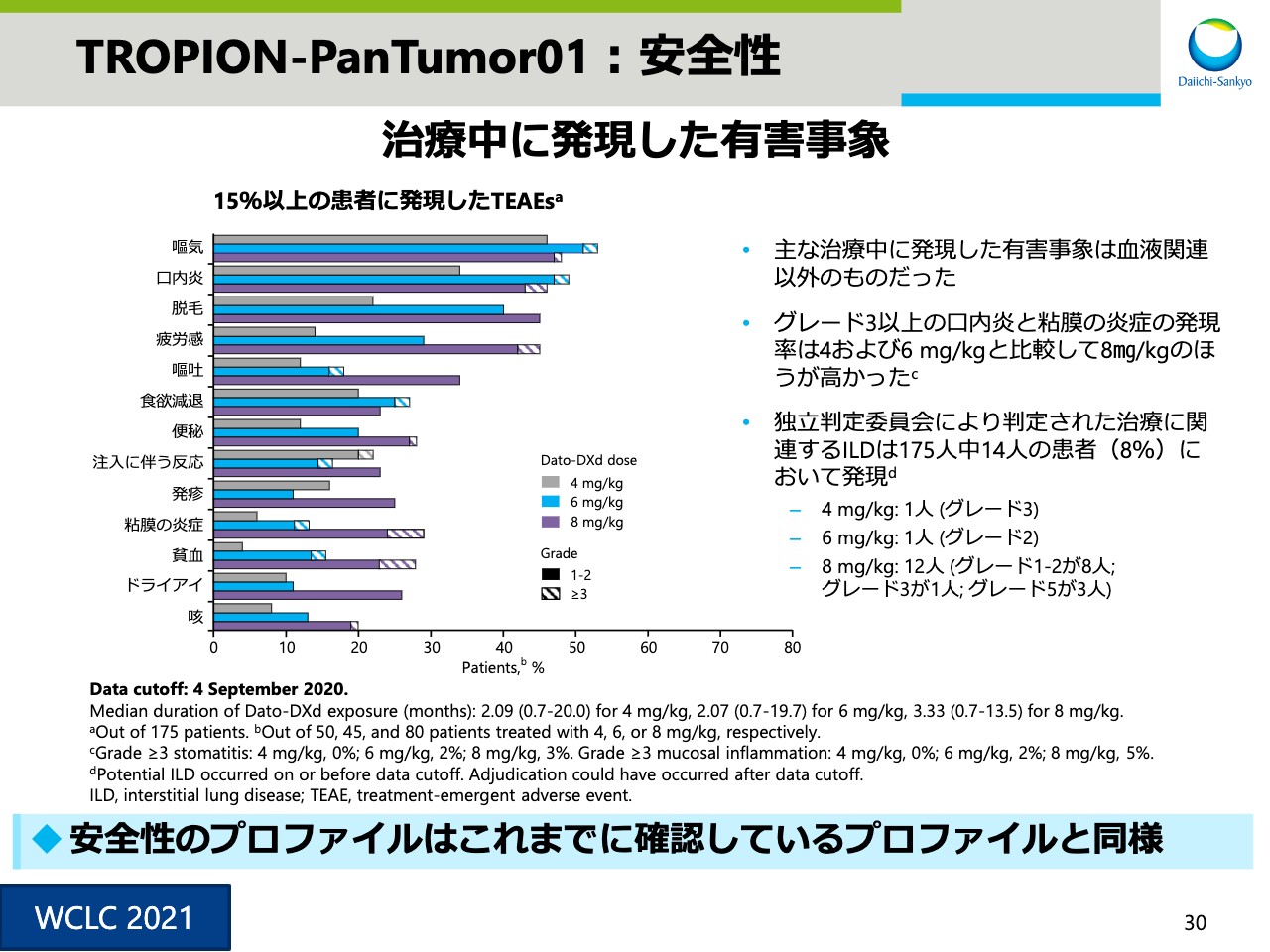
スライド30は安全性の詳細です。ILDについては、スライドの右の3つ目の項目にありますように、8mg/㎏でやや多いものの、4mg/kg、6mg/kgでは1例ずつの発現でした。
TROPION-PanTumor01:薬物動態
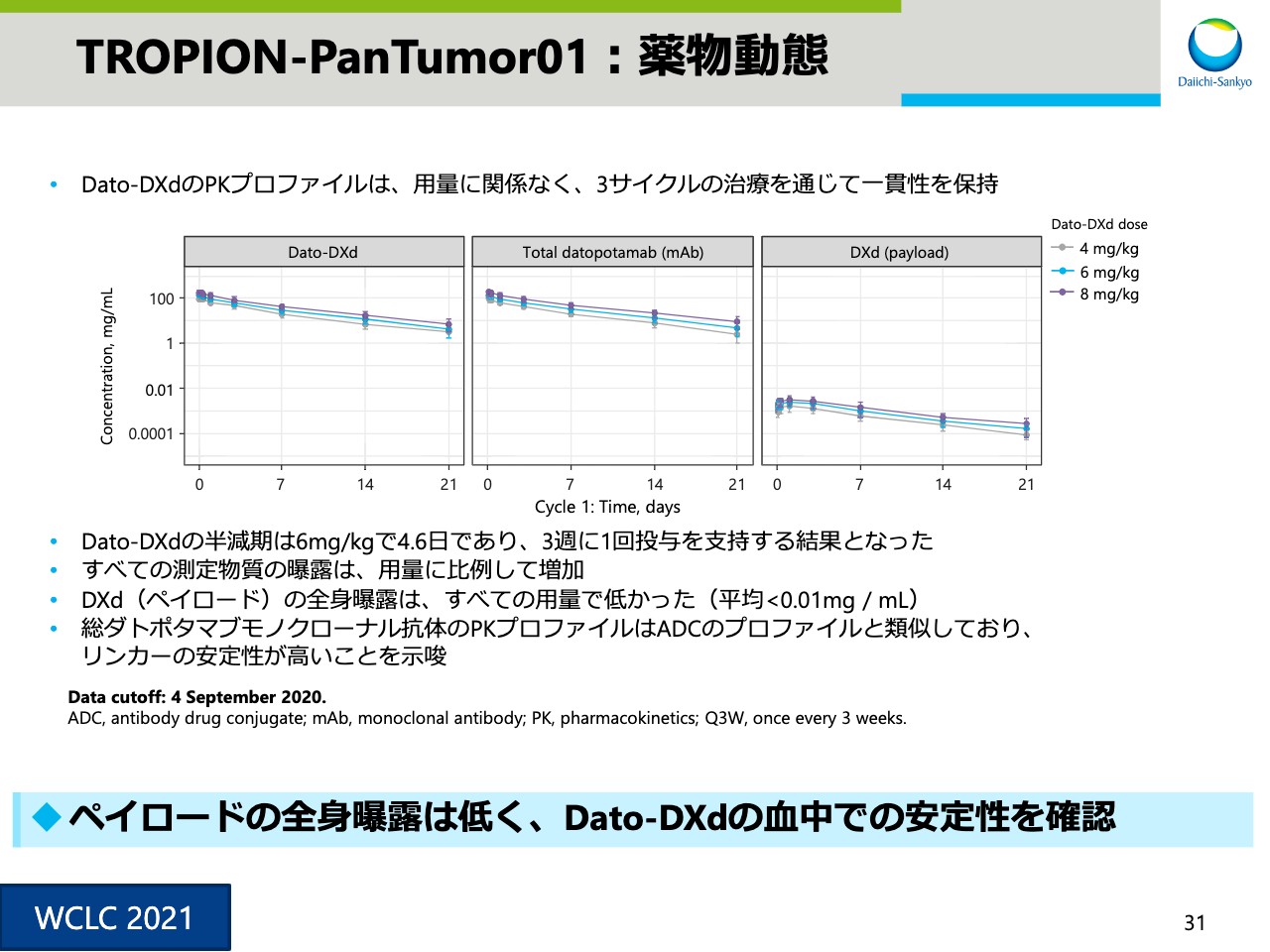
スライド31はPKプロファイルです。ペイロードの全身曝露は低く、「Dato‐DXd」が血中で安定していることが確認できました。
TROPION-PanTumor01:有効性
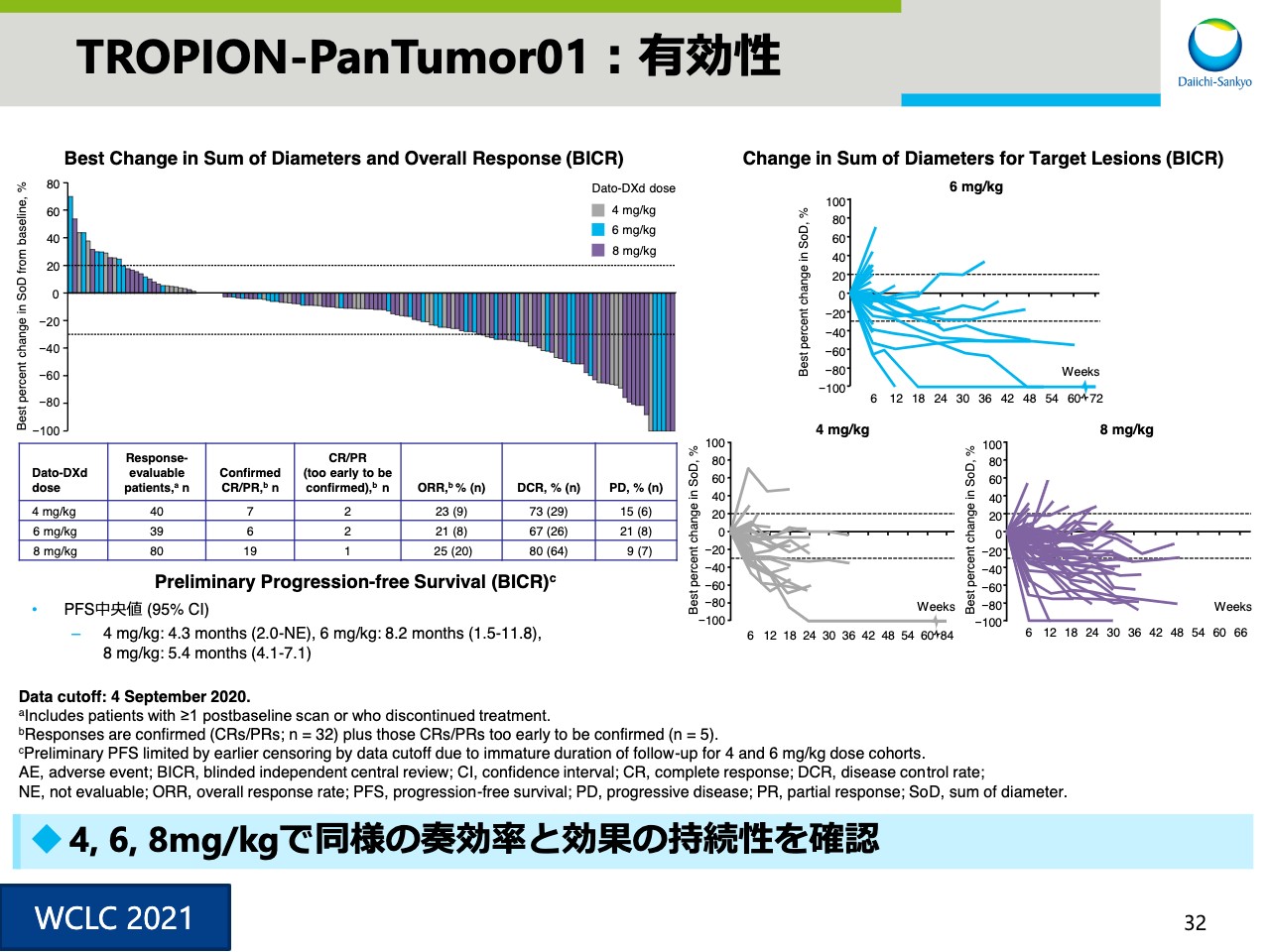
スライド32は有効性のデータです。4mg/kg、6mg/kg、および8mg/kgで同様の奏効率や効果の持続性を確認することができました。
TROPION-PanTumor01:サマリー

スライド33は、「Dato-DXd」のフェーズ1試験、肺がんのサマリーになります。今回の中間データより、忍容性に関しては4mg/㎏および6mg/kgのほうが8mg/kgよりも高いことが認められました。一方で有効性に関しては、4mg/kg、6mg/kg、8mg/kgでほぼ同等のデータが認められました。よって、今後行うフェーズ3試験の推奨用量として6mg/kgを選択しました。
HER3-DXd:NSCLC P1試験における遺伝子異常
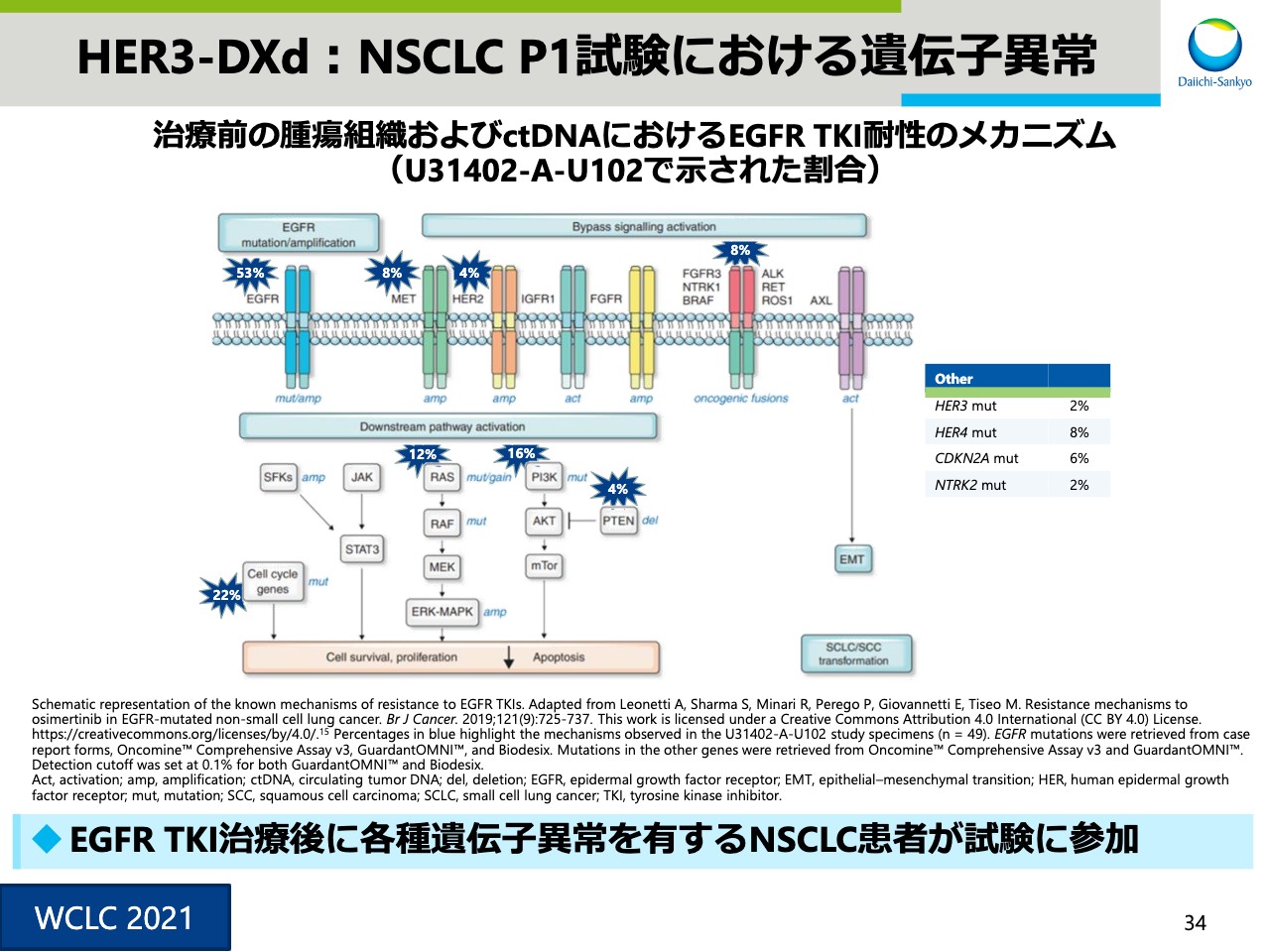
スライド34からは、本日、世界肺がん学会で発表しました「U3‐1402」「HER3-DXd」の肺がんフェーズ1試験で得られたHER3のバイオロジーに関するデータをご紹介いたします。スライド34では、「HER3-DXd」治療前の腫瘍組織で観察されたそれぞれの遺伝子異常の割合を示しています。EGFRチロシンキナーゼ阻害剤投与後に発現する各種遺伝子異常を有する患者が試験にエントリーしていることがわかりました。
HER3-DXd:各種遺伝子異常における有効性
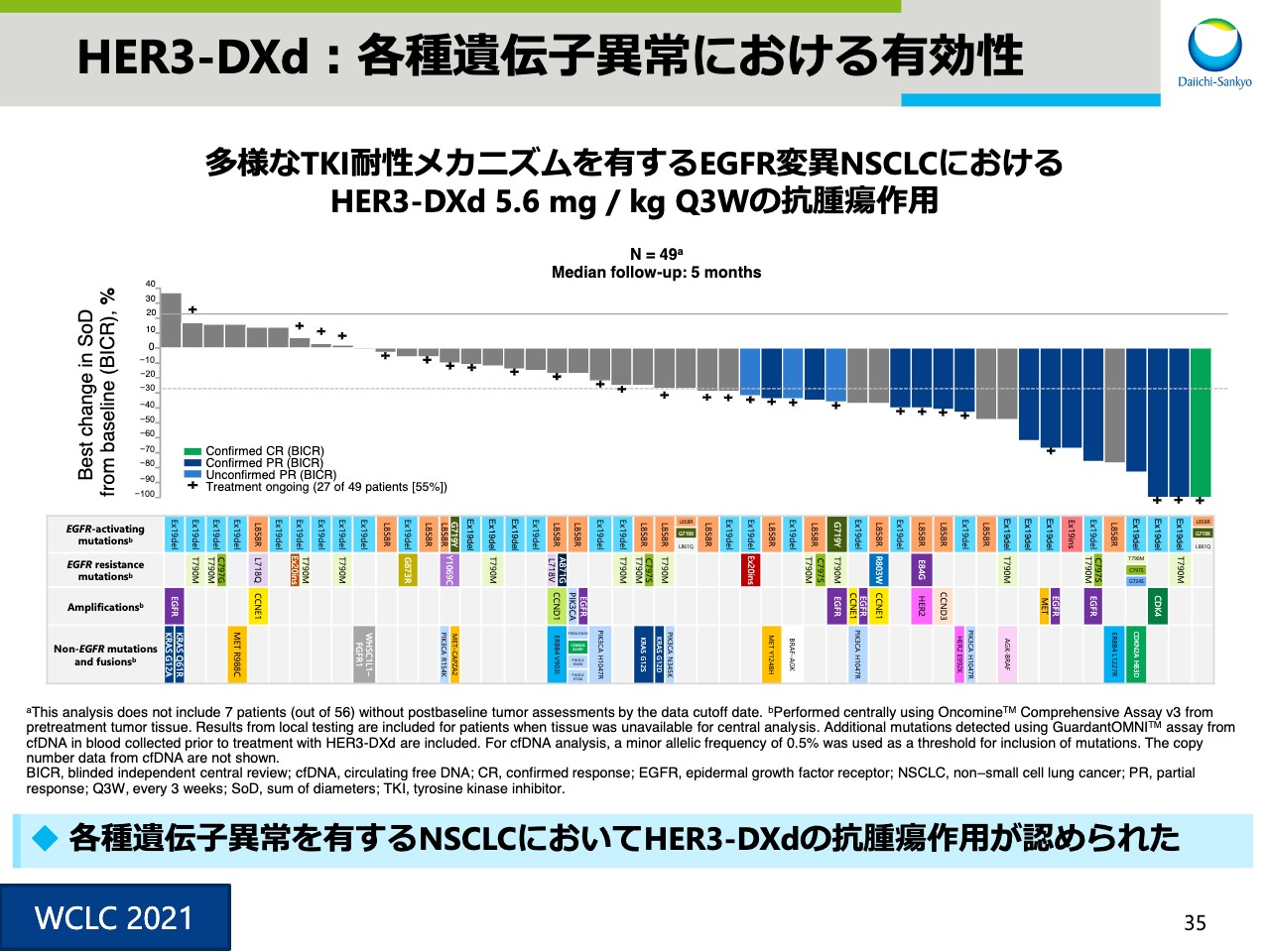
スライド35は、以前にもお示ししたウォーターフォールプロットです。各種遺伝子異常を有する肺がん患者において「HER3‐DXd」の抗腫瘍作用が認められています。
HER3-DXd :NSCLC患者でのHER3発現
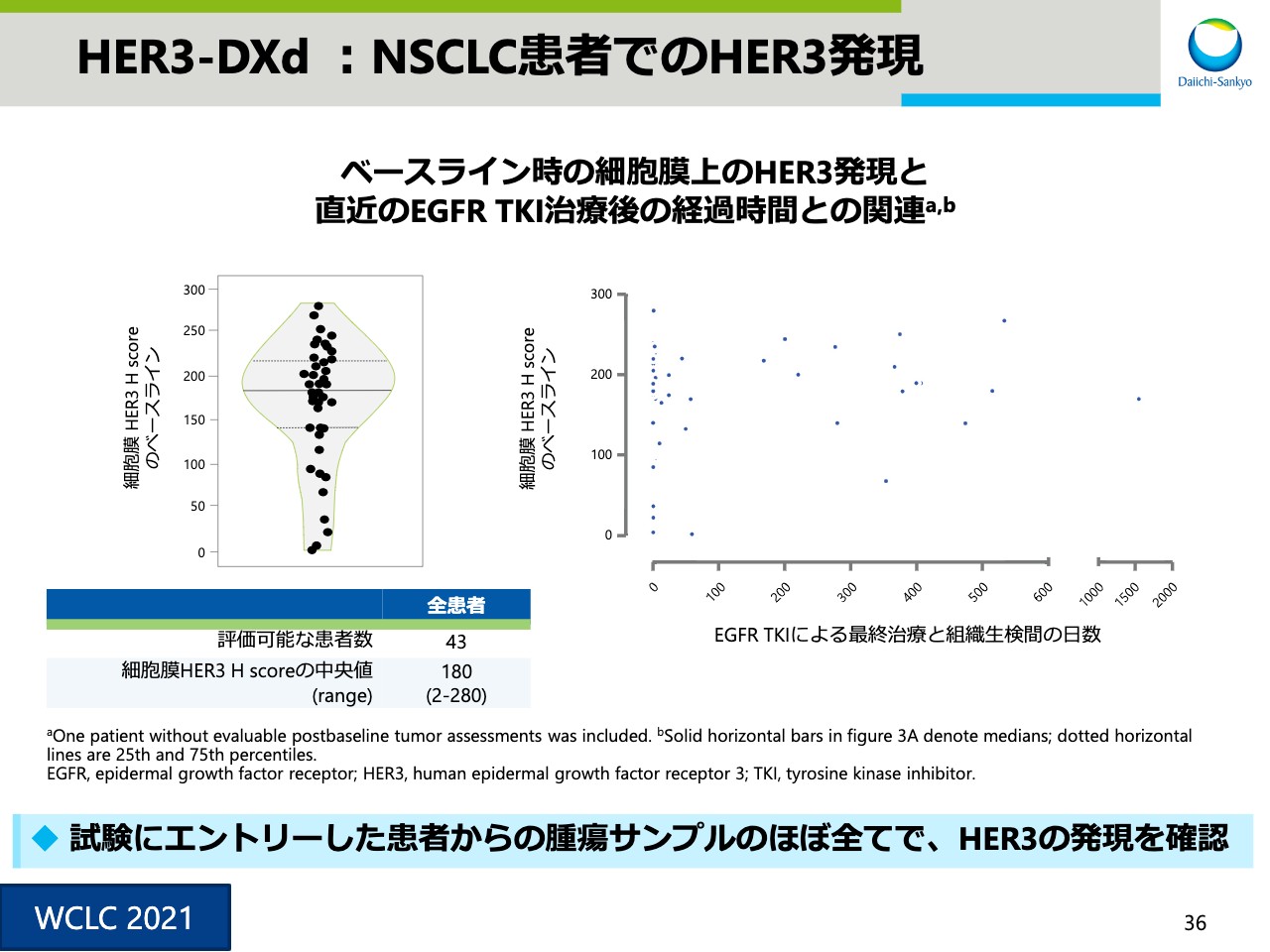
スライド36は、肺がん患者におけるHER3の発現状況を示した図です。本試験では、HER3による患者選択を行っていませんが、ほぼすべての患者でHER3の発現を確認できました。
HER3-DXd :HER3の発現と有効性の関係
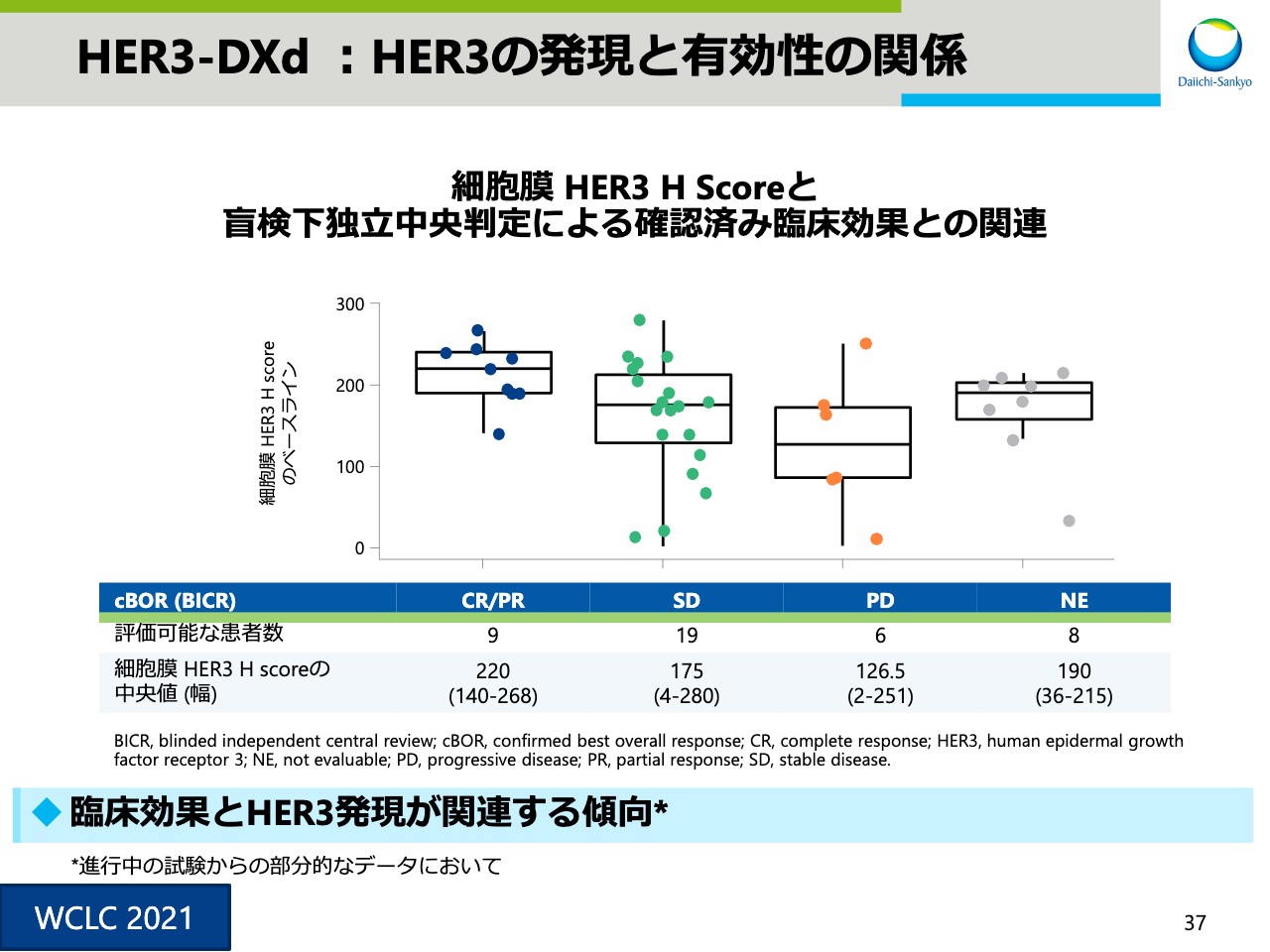
スライド37は、HER3の発現と有効性の関係性を示した図です。臨床効果とHER3の発現が関連する傾向がございましたが、症例数も少ないため、今後さらに検討を行います。3ADCのアップデートは以上になります。
DS-6000:ターゲット抗原 CDH6
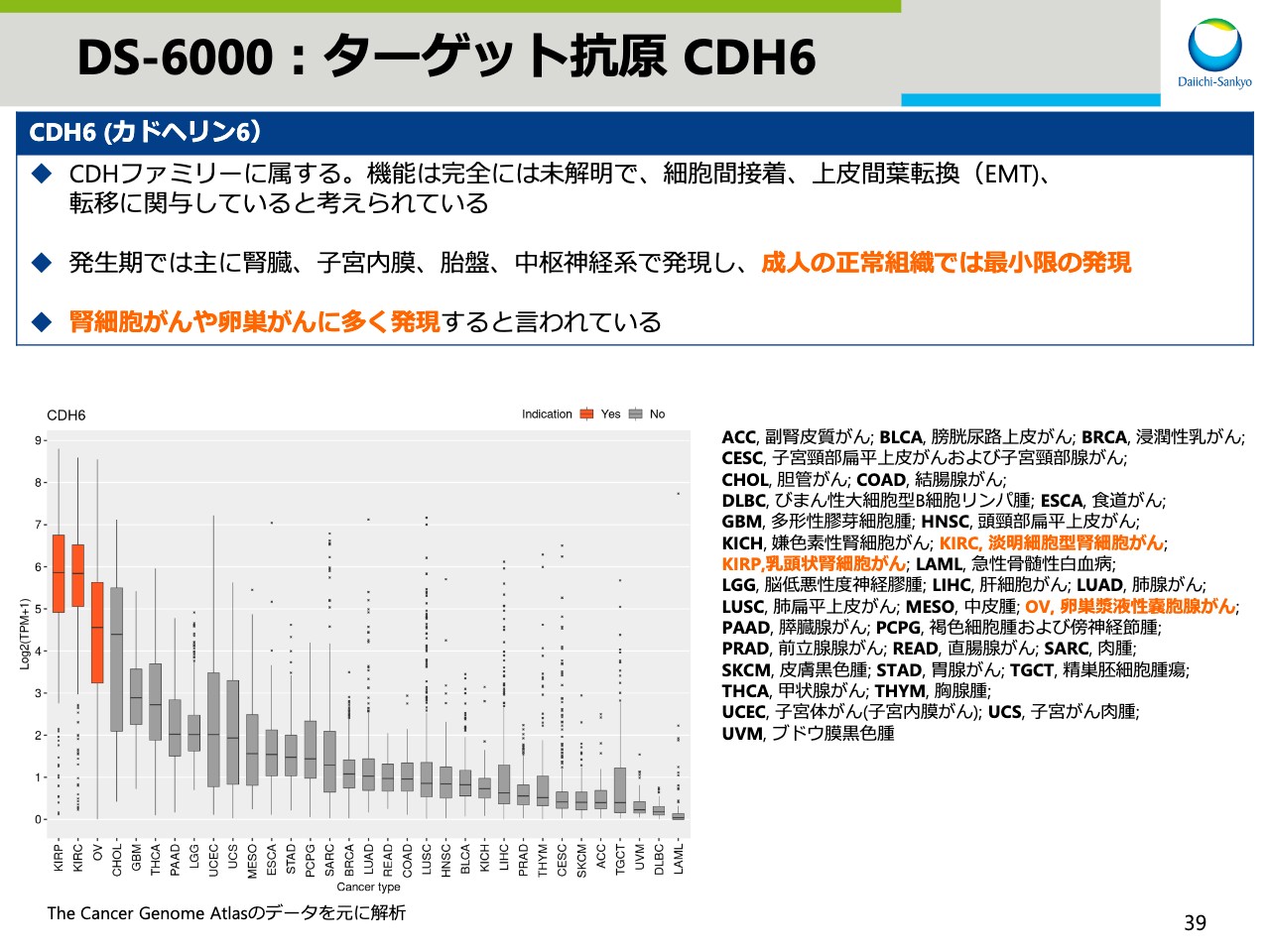
引き続きスライド38からは、Alphaのアップデートです。スライド39はR&D Dayでも簡単にご紹介しました「DS-6000」についてです。「DS-6000」は当社のDXd、ADCテクノロジーを用いた6番目のADCで、そのターゲットはカドヘリン6、薬物抗体比は8です。
カドヘリン6の機能の詳細はまだ未解明ですが、がんの転移などに関与していると考えられています。下の図はカドヘリン6の各種がん種での発現状況を示しています。腎細胞がんや卵巣がんで多く発現していることが知られています。
DS-6000:がん種とフェーズ1試験デザイン
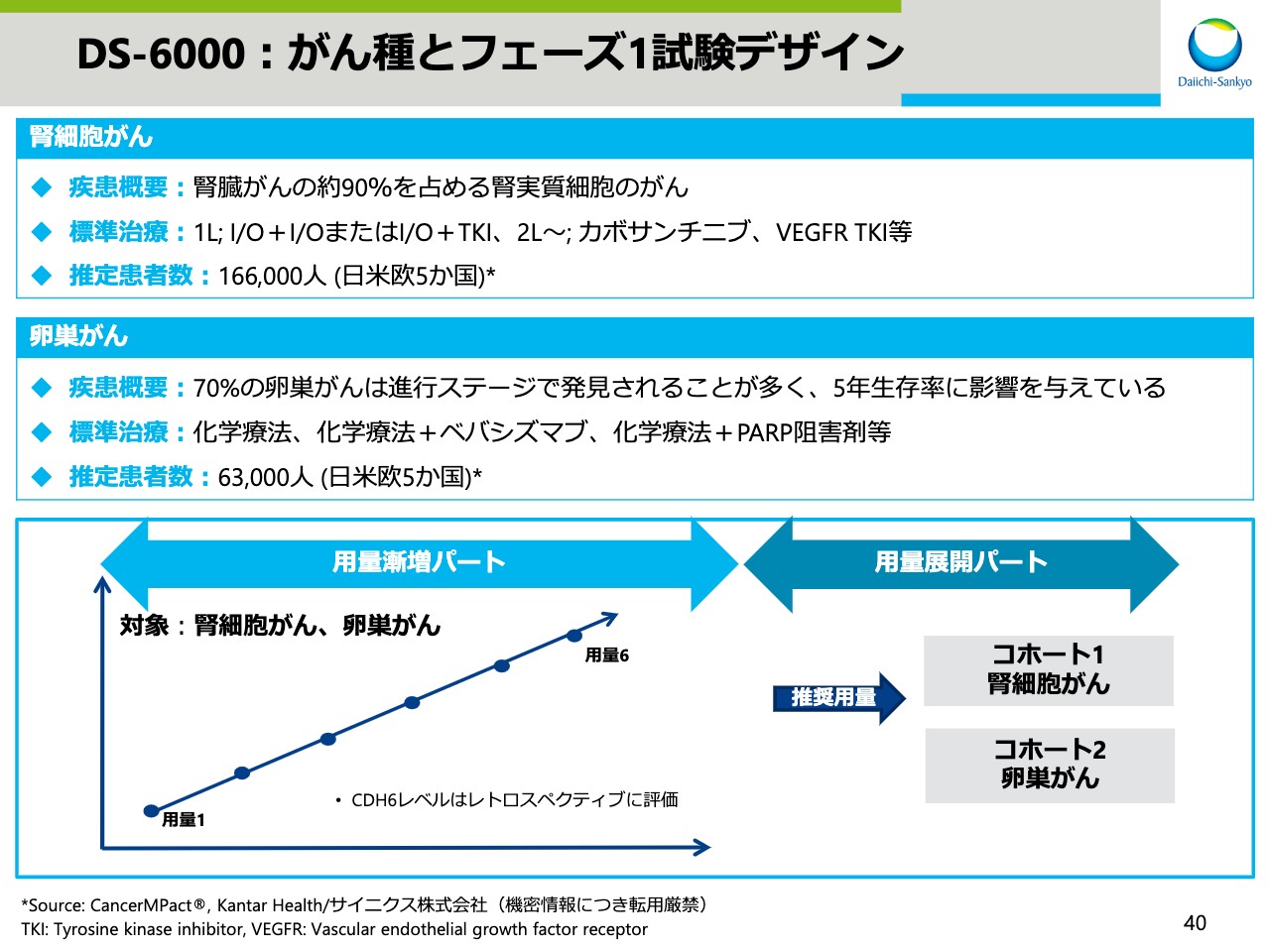
スライド40では、腎細胞がん、卵巣がんの疾患概要、その標準治療、推定患者数、およびフェーズ1試験のデザインを示しています。本試験は今週から投与が開始しました。
DS-1647 (G47Δ):悪性神経膠腫

スライド41は、がん治療用ウイルス「DS-1647」についてです。2020年12月に承認申請しました。本製品は、東京大学医科学研究所の藤堂先生が実施された医師主導治験の結果を元に申請しています。先駆け審査指定品目のため、2021年度上期の承認を見込んでいます。
エフィエント®:虚血性脳血管障害

スライド42は「エフィエント」についてです。2012年12月に脳領域で承認事項一部変更承認申請を行いました。「エフィエント」は、以前実施した検証試験においてクロピドグレルに対する非劣性を検証することができませんでした。
その後、アテローム血栓性脳梗塞、およびラクナ梗塞患者を対象に新たなフェーズ3試験を実施し、その試験で主要評価項目を達成したことから、これまでの試験結果とともに申請を行いました。2021年度第3四半期の承認を見込んでいます。アペンディクスに過去に行った2つの試験と今回の試験の概要をまとめていますので、後ほどご確認ください。
DS-5141:デュシェンヌ型筋ジストロフィー

スライド43は、「DS-5141」についてです。2020年12月に、デュシェンヌ型筋ジストロフィーを対象としたフェーズ1、フェーズ2試験のトップラインリザルツが得られています。すでにプレスリリースでご案内しているとおり、安全性に関する懸念は認められませんでした。
有効性については、Exon45スキッピングにより得られたメッセンジャーRNAの産生を、すべての患者で確認することができました。また、ジストロフィンタンパク質の明らかな増加を複数の患者で確認することができました。引き続き詳細な解析を行い、今後の承認申請に関しては規制当局と協議していく予定です。
タリージェ®:中枢性神経障害性疼痛

スライド44は「タリージェ」についてです。2020年12月に、中枢性神経障害性疼痛を対象としたフェーズ3試験のトップラインリザルツが得られました。こちらもすでにプレスリリースでご案内しているとおり、新たな安全性上の懸念は認められませんでした。
また有効性に関しても、平均疼痛スコアのベースラインから14週目までの変化量が、プラセボ投与群に対して優越性を示しました。2021年度第1四半期の承認申請を目標としております。Alphaのアップデートは以上になります。
今後のニュースフロー

スライド46では、今後、半年先ぐらいまでのニュースフローを示していますので、後ほどご確認ください。スライド47以降はアペンディクスになります。マイルストン一覧、パイプライン一覧を掲載しておりますので、こちらも後ほどご確認ください。私からの発表は以上になります。